题目内容
【题目】氟化锂(LiF)难溶于水,可用于核工业、光学玻璃制造等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如下:
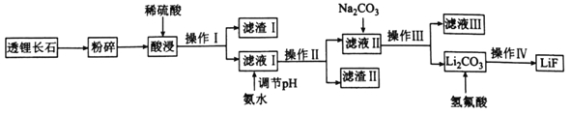
回答下列问题:
(1)滤液I中含有的金属离子有________,滤渣I的一种用途是________________。
(2)滤渣Ⅱ是目前应用最广泛的无机阻燃剂,写出生成滤渣Ⅱ的离子方程式:________________。常温下,若向滤液I中滴加氨水调节pH=5时,溶液中c(Al3+)=________mol·L-1,则溶液中A13+________(填“是”或“否”)沉淀完全(已知Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度小于1.0×10-5mol·L-1时沉淀完全)。
(3)操作Ⅳ包括________________、________________和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式:________________________,该反应不能在玻璃容器中进行的原因是________________________(用化学方程式表示)。
【答案】Li-、Al3+ 制作光导纤维(或制玻璃、制粗硅等,答案正确即可) Al3++3NH3·H2O=Al(OH)2↓+3NH4+ 2.0×10-6 是 过滤 洗涤 Li2CO3+2HF=2LiF+CO2↑+H2O 4HF+SiO2=2H2O+SiF↑
【解析】
通过流程图分析各步发生的化学反应,根据溶度积常数判断沉淀是否完全。
(1) Li2O、Al2O3与硫酸反应生成硫酸锂和硫酸铝,所以滤液I中含有的金属离子有Li-、Al3+ ;滤渣I是二氧化硅,它的一种用途是制作光导纤维,
故答案为:Li2O、Al2O3,制作光导纤维;
(2)滤渣Ⅱ是氢氧化铝沉淀,离子方程式为:Al3++3NH3·H2O=Al(OH)2↓+3NH4+;
c(OH-)=Kw/c(H+)=10-14/10-5=10-9,Ksp[Al(OH)3]= c(Al3+) c3(OH-)= c(Al3+)![]() (10-9)3=2.0×10-33,则c(Al3+)=2.0×10-6mol·L-1,铝离子完全沉淀,
(10-9)3=2.0×10-33,则c(Al3+)=2.0×10-6mol·L-1,铝离子完全沉淀,
故答案为:Al3++3NH3·H2O=Al(OH)2↓+3NH4+;2.0×10-6;是;
(3)由流程图知操作Ⅳ包括过滤、洗涤和干燥,
故答案为:过滤、洗涤;
(4)Li2CO3与氢氟酸发生复分解反应,化学方程式:Li2CO3+2HF=2LiF+CO2↑+H2O;氢氟酸与玻璃种二氧化硅反应,所以不能在玻璃容器中进行,方程式为:4HF+SiO2=2H2O+SiF↑,
故答案为:Li2CO3+2HF=2LiF+CO2↑+H2O;4HF+SiO2=2H2O+SiF↑。

 新思维寒假作业系列答案
新思维寒假作业系列答案