题目内容
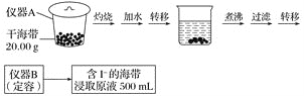
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
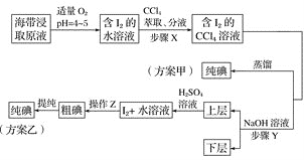
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
【答案】坩埚 500 mL容量瓶 向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 液体分上下两层,下层呈紫红色 AB 过滤 主要由于碘易升华,会导致碘的损失
【解析】
(1)在仪器A中灼烧海带,该仪器为坩埚;配制溶液体积为500mL,应该选用规格为500mL的容量瓶;
(2)①检查分液漏斗是否漏水,需要分别检查瓶塞、旋塞是否漏水;
②碘单质易溶于有机溶剂,且四氯化碳溶液密度大于水溶液,检查判断萃取现象;
③A.反应3I2+6NaOH=5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液;
B.碘单质与氢氧化钠反应生成了碘化钠、碘酸钠;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,便于后续分离出碘单质;
D.乙醇易溶于水和四氯化碳,仍然无法分离出碘单质.
④碘单质不溶于水,可以通过过滤操作分离出碘单质;
(3)从碘单质易升华角度分析。
(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,故答案为:坩埚;500mL容量瓶;
(2)①分液漏斗的检漏应先检查漏斗颈旋塞处是否漏水,再检查漏斗口玻璃塞处是否漏水,其方法是:检查漏斗颈旋塞处是否漏水时,先关闭分液漏斗的旋塞,加入适量的水,看是否漏水,若不漏,再将活塞旋转180°后观察是否漏水;检查漏斗口玻璃塞处是否漏水时,先关闭分液漏斗的旋塞,加入适量的水,把漏斗倒过来观察是否漏水,若不漏,将玻璃塞旋转180度后再倒置观察,若还是不漏水,则玻璃塞处不漏水;
②步骤X为萃取操作,由于CCl4密度比水大,且I2易溶于CCl4,故萃取后分液漏斗内观察到的现象液体分为上下两层,上层呈无色,下层呈紫红色;
③据题中所给信息:3I2+6NaOH=5NaI+NaIO3+3H2O,步骤Y目的在于把碘元素全部由CCl4层转移入水层,NaOH溶液应过量,为了下一步便于提取碘,所加氢氧化钠溶液的体积不能过多,故其浓度不能太小,故选项A、B正确,选项C错误,由于I2在CCl4和酒精中都易溶解,且CCl4和酒精互溶,酒精不能从I2的CCl4溶液中萃取I2,选项D错误;
答案选AB;
④实验(二)中,由于碘单质在酸性溶液的溶解度很小,碘在水溶液中以晶体析出,故操作Z是过滤;
(3)由于碘易升华,加热碘的四氯化碳溶液时,碘易挥发,会导致碘的损失,故不采用蒸馏方法。

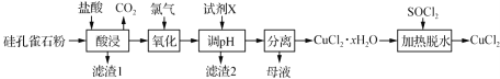
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
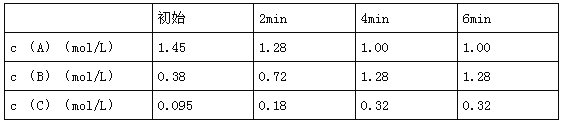
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2