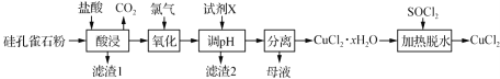
题目内容
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。

①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:
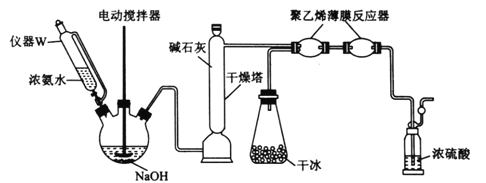
①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
【答案】d 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
【解析】
根据装置图中各仪器的构造和作用分析解答;由题干信息计算反应热,进而书写热化学方程式。
(1)①为了使气体充分干燥,气体从大口通入,应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:d,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②制备并纯化CO2时,先通过饱和碳酸氢钠溶液除去氯化氢,然后通入浓硫酸干燥,所以按气流从左至右的方向,各接口连接顺序为bhgef,
故答案为:bhgef;
(2) ①根据图中装置的构造可知,用仪器W代替分液漏斗的优点是:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;用干冰装置代替(1)中制备并纯化CO2装置的优点是:装置简单,产生的CO2不需净化和干燥,
故答案为:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;装置简单,产生的CO2不需净化和干燥;
②生成1.0g氨基甲酸铵放出2.05kJ的热量,则生成1mol放出的热量为159.90kJ,所以热化学方程式为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;盛浓硫酸的装置的作用是:吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等,
故答案为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等;
③体系中若有水蒸气,可与二氧化碳反应生成碳酸,碳酸与氨气反应生成盐,所以还可能生成的铵盐是(NH4)2CO2(或NH4HCO3),
故答案为:(NH4)2CO2(或NH4HCO3)。