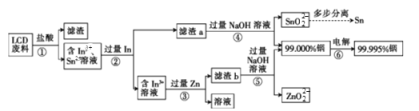
题目内容
【题目】W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是 ________________。W 的气态氢化物能使紫色石蕊溶液变蓝的原因:__________________(用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:_____。
(3)Z 最高价氧化物对应的水化物化学式为 ____。
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式_____。
【答案】![]() NH3+H2O
NH3+H2O![]() NH3·H2O Cl->Na+>Al3+ HClO4 SOCl2+H2O=SO2↑+2HCl↑
NH3·H2O Cl->Na+>Al3+ HClO4 SOCl2+H2O=SO2↑+2HCl↑
【解析】
因为W、X、Y、Z 是原子序数依次增大的短周期元素,W的气态氢化物能使紫色石蕊溶液变蓝,可确定W是氮元素。W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,可推测其中一种最高价氧化物的水化物具有两性,两性氢氧化物既可以与强酸反应,也可以与强碱反应,由此可确定X、Y。最后根据W、X、Y、Z 的最外层电子数之和为 16,计算Z的最外层电子数,可确定Z的元素种类。
因为W、X、Y、Z 是原子序数依次增大的短周期元素,W的气态氢化物能使紫色石蕊溶液变蓝,可确定W是氮元素。W、X和Y 三种元素的最高价氧化物的水化物两两之间可以发生反应,且W的最高价氧化物的水化物是HNO3(属于强酸),可推知其中一种元素是铝(其最高价氧化物的水化物是Al(OH)3,属于两性氢氧化物),另一种元素应该是活泼金属(其最高价氧化物的水化物是强碱),因此可确定X是钠、Y是铝。由于W、X、Y、Z 的最外层电子数之和为 16,所以Z的最外层电子数=16-5-1-3=7,又因Z的原子序数比Y大,所以Z为氯元素。结论:W为氮、X为钠、Y为铝、Z为氯。
(1)Z的单质是Cl2,两个氯原子间通过一对共用电子相结合,其电子式为![]() 。W 的气态氢化物是氨气,氨气能与水反应生成一水合氨,一水合氨属于弱碱使溶液显碱性,发生反应的化学方程式为:NH3+H2O
。W 的气态氢化物是氨气,氨气能与水反应生成一水合氨,一水合氨属于弱碱使溶液显碱性,发生反应的化学方程式为:NH3+H2O![]() NH3·H2O。
NH3·H2O。
(2) X、Y、Z分别对应的离子符号是Na+、Al3+、Cl-,Na+与Al3+的电子层结构相同(都是10个电子),因为核电荷数越大离子半径越小,所以Na+半径大于Al3+半径。而Cl-核外有18个电子,其电子层比Na+和Al3+多一层,因此Cl-半径比Na+和Al3+半径都大,所以三种简单离子的离子半径由大到小的顺序是Cl->Na+>Al3+。
(3)Z为氯元素,其最高价为+7价,氯元素的最高价氧化物对应的水化物化学式为HClO4。
(4)因SOCl2遇水能剧烈水解,“有白雾产生”推测有HCl气体生成;“有能使滴有品红试液的滤纸褪色”推测有SO2产生,HCl和SO2都具有刺激性气味。所以SOCl2水解反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案