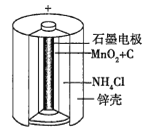
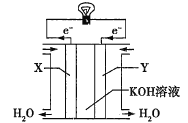
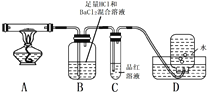
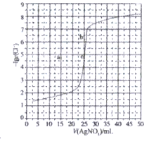
题目内容
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
【答案】否 正向 80%
【解析】
(1)当SO2的转化率为50%,转化SO2为0.4mol/L×50%=0.2mol/L,此时SO2、O2、SO3的浓度依次为0.2mol/L、0.9mol/L、0.2mol/L,浓度商Qc=![]() =1.1<K=19 ,反应未达到平衡状态,向正方向进行。
=1.1<K=19 ,反应未达到平衡状态,向正方向进行。
(2)设转化O2的浓度为xmol/L
2SO2+ O2 ![]() 2SO3
2SO3
起始浓度(mol/L) 0.4 1 0
转化浓度(mol/L) 2x x 2x
平衡浓度(mol/L) (0.4-2x) (1-x) 2x
依据平衡常数的定义,则:
![]() ,解得:x=0.16
,解得:x=0.16
SO2的转化率应为![]() ×100%=80%。
×100%=80%。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应