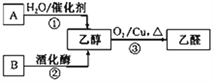
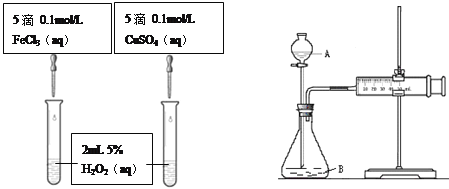
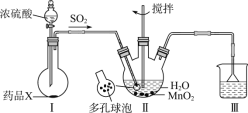
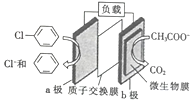
题目内容
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法中,错误的是( )。

A.燃料电池中通入氢气一端的多孔电极为负极
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4 OH-
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.乙装置可实现将电能转化为化学能
【答案】B
【解析】
A. 还原剂失电子,在负极发生氧化反应,燃料电池中通入氢气一端的多孔电极为负极,故A正确;
B. 燃料电池工作时,在酸性条件下,正极反应为:O2 +4H++ 4e-= 2H2O,故B错误;
C. 该燃料电池的总反应就是氢气与氧气发生反应生成水:2H2+O2=2H2O,故C正确;
D. 乙装置是电解池,可实现将电能转化为化学能,故D正确;
故选B。

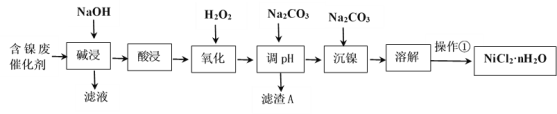
【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如下:
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Ni的原子序数为28,位于元素周期表第四周期,最外层电子数为2,则其原子结构示意图为________________。
(2)“酸浸”、“溶解”所使用的酸为_____________。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、___________________。
(3)“氧化”加入H2O2溶液,其作用是____________________(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____________。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至_________________________为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)为了测定NiCl2nH2O中结晶水数目进行如下实验:取23.8 g样品在一定条件下脱水得13.0 g NiCl2,则n=__________。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。