题目内容
【题目】已知:pNi= -lg c(Ni2+),常温下H2S的电离平衡常数:Kal=l. 3×10-7,Ka2=7. 1×10-15。常温下,向10 mL 0. 1 molL-1Ni(NO3)2溶液中滴加0.1 molL-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法正确的是
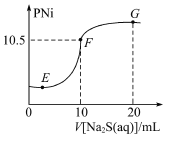
A.E、F、G三点中,F点对应溶液中水电离程度最大
B.常温下,Ksp(NiS) = 1×10-21
C.Na2S溶液中 c(S2- )+c(HS- )+c(H2S) =c(Na+)
D.Na2S溶液中,S2-第一步水解常数Kh1=![]()
【答案】BD
【解析】
A.Ni(NO3)2是强酸弱碱盐,Ni2+水解,促进水的电离,使溶液显酸性,如Ni(NO3)2与H2S恰好完全反应,生成硝酸钠,此时水的电离程度最小,由图可知,F点对应溶液中水电离程度最小,A错误;
B.完全沉淀时,pNi=-lgc(Ni2+)=10.5,Ksp(NiS)=c(Ni2+)·c(S2-)=1×10-10.5×1×10-10.5=1×10-21,B正确;
C.根据物料守恒可得2c(S2-)+2c(HS-)+2c(H2S) =c(Na+),C错误;
D.S2-第一步水解常数Kh1=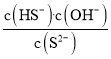 =
=![]() ,D正确;
,D正确;
故合理选项是BD。

【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如下:
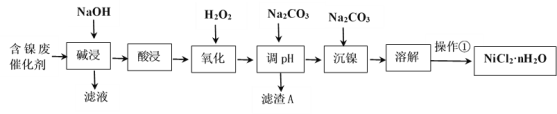
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Ni的原子序数为28,位于元素周期表第四周期,最外层电子数为2,则其原子结构示意图为________________。
(2)“酸浸”、“溶解”所使用的酸为_____________。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、___________________。
(3)“氧化”加入H2O2溶液,其作用是____________________(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____________。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至_________________________为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)为了测定NiCl2nH2O中结晶水数目进行如下实验:取23.8 g样品在一定条件下脱水得13.0 g NiCl2,则n=__________。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。