题目内容
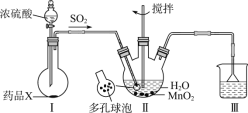
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
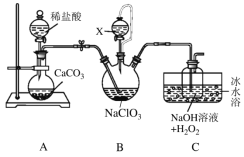
已知:①ClO2沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl。
③B装置为ClO2发生装置,所用试剂NaClO3、H2SO4(浓)、CH3OH。
请回答下列问题:
(1)装置B中试剂X的名称为___________;盛放该试剂的仪器的名称为________________。
(2)实验过程中需持续通入一定量的CO2,其目的是______________;反应结束后需再通入一定量的CO2,其目的是_____________________。
(3)装置C中的水浴温度应控制在____________________(填温度范围);装置C中生成NaClO2的离子方程式为___________________。
(4)上述装置存在一处明显的缺陷,其改进措施为__________________。
【答案】浓硫酸 分液漏斗 使ClO2中混有一定量的CO2,防止ClO2浓度过高发生爆炸 将装置中残留的ClO2吹入装置C中参与反应,提高原料的利用率 38℃到60℃之间 2OH-+2ClO2+H2O2=2ClO2-+O2↑+2H2O 导气管末端接一个装有NaOH溶液的洗气瓶进行尾气处理
【解析】
在A中CaCO3与稀盐酸反应产生CO2进入B装置中,可以稀释B中由NaClO3、H2SO4(浓)、CH3OH反应制取的ClO2,防止ClO2浓度较高时发生爆炸,然后将ClO2通入NaOH、H2O2的混合溶液中,发生反应2OH-+2ClO2+H2O2=2ClO2-+O2↑+2H2O,用冰水浴38℃到60℃之间,就得到NaClO2。
(1)装置B是用NaClO3、H2SO4(浓)、CH3OH反应制取的ClO2,NaClO3、CH3OH在三颈烧瓶,浓硫酸在分液漏斗中,装置B中试剂X的名称为浓硫酸,盛放该试剂的仪器的名称为分液漏斗;
(2)实验过程中需持续通入一定量的CO2,目的是使ClO2中混有一定量的CO2,降低ClO2的浓度,防止ClO2浓度过高发生爆炸;反应结束后容器内会滞留一部分ClO2,再通入一定量的CO2,可以将装置中残留的ClO2吹入装置C中参与反应,从而提高原料的利用率;
(3)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl,所以装置C中的水浴温度应控制在38℃到60℃之间;在装置C中,NaOH、ClO2、H2O2反应生成NaClO2、O2、H2O,反应的离子方程式为2OH-+2ClO2+H2O2=2ClO2-+O2↑+2H2O;
(4)ClO2是有毒气体,该反应后缺少尾气处理装置,会导致大气污染,可根据ClO2能够与碱反应的性质,在导气管末端接一个装有NaOH溶液的洗气瓶进行尾气处理。