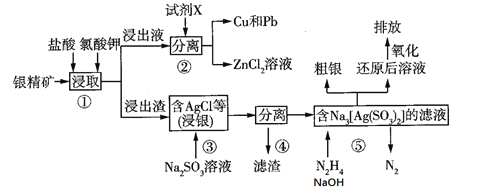
题目内容
【题目】(1)盐酸中加入少量K2FeO4固体,产生黄绿色气体。该反应的化学方程式是___。
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___。
(3)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:___。
(4)Cl2与热的NaOH溶液反应生成NaClO3,该反应的离子方程式为___。
(5)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,写出该反应的离子方程式:___。
【答案】2K2FeO4+16HCl=4KCl+2FeCl3+3Cl2↑+8H2O 2Ag++ClO+2OH=Ag2O2↓+Cl+H2O 2Mg(OH)2+2SO2+O2=2MgSO4+2H2O 3Cl2+6OH![]() ClO3+5Cl+3H2O 3HSO3+Cr2O72+5H+=2Cr3++3SO42+4H2O
ClO3+5Cl+3H2O 3HSO3+Cr2O72+5H+=2Cr3++3SO42+4H2O
【解析】
(1)产生黄绿色气体,可知此反应发生氧化还原反应,根据电子守恒和原子守恒书写方程式;
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2,同时生成氯化钠和水,结合原则守恒和电荷守恒配平书写离子方程式;
(3)向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,应生成硫酸镁,则反应物还应有氧气,据此分析书写方程式;
(4) Cl2与热的NaOH溶液反应生成NaCl、NaClO3和水;
(5)在酸性条件下,NaHSO3使Cr2O72还原成为Cr3+,NaHSO3被氧化为硫酸钠,结合得失电子守恒和原子守恒分析。
(1)盐酸中加入少量K2FeO4固体,产生黄绿色气体。可知此反应发生氧化还原反应,还原产物应为FeCl3,根据电子守恒和原子守恒可知发生反应的化学方程式为2K2FeO4+16HCl=4KCl+2FeCl3+3Cl2↑+8H2O;
(2)用NaClONaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2,同时还会生成NaCl和水,氧元素从2价被氧化成Ag2O2中的1价,化合价至少升高2价;NaClO中Cl元素从+1价被还原为1价的Cl,然后结合原则守恒和电荷守恒配平,该反应的离子方程式为:2Ag++ClO+2OH=Ag2O2↓+Cl+H2O;
(3)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,应生成硫酸镁,则反应物还应有氧气,反应的化学方程式为2Mg(OH)2+2SO2+O2=2MgSO4+2H2O;
(4) Cl2与热的NaOH溶液反应生成NaCl、NaClO3和水,该反应的离子方程式为:3Cl2+6OH![]() ClO3+5Cl+3H2O;
ClO3+5Cl+3H2O;
(5)在酸性条件下,NaHSO3使Cr2O72还原成为Cr3+,NaHSO3被氧化为硫酸钠,反应的离子方程式为:3HSO3+Cr2O72+5H+=2Cr3++3SO42+4H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某些共价键的键长数据如下表所示。试根据下表回答问题。
共价键 |
|
|
|
|
|
|
|
|
键长 | 0.154 | 0.134 | 0.121 | 0.143 | 0.123 | 0.146 | 0.122 | 0.110 |
(1)根据表中有关数据,你能推断出影响共价键键长的因素主要有哪些?_______。其影响的结果怎样?__________。
(2)通常,键能越__________,共价键越____,由该键构成的分子越稳定。