题目内容
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银、铜和铅,工艺流程如图所示。

(1)步骤①当盐酸的浓度和KClO3的量一定时,写出两点可提高“浸取”速率的措施______;从Cu和Pb混合物中提取Cu的试剂为______(填名称)。
(2)步骤③反应的化学方程式为______。
(3)步骤④分离出的滤渣中主要含有两种杂质,为了回收滤渣中的非金属单质,某实验小组向滤渣中加入试剂______(填化学式),充分溶解后过滤,然后将滤液进行______(填操作名称),得到该固体非金属单质。
(4)步骤⑤反应中氧化剂和还原剂的物质的量之比为______。
(5)排放后的废水中含有NO3-,任意排放会造成水体污染,科技人员在碱性条件下用Al粉将NO3-还原成无污染气体排放,该方法的缺点是处理后的水中生成了AlO2-,依然对人类健康有害。该反应的离子方程式为:______。25℃时,欲将上述处理过的水中的c(AlO2-)降到1.0×10-7mol/L,此时水中c(Al3+)=______molL-1.(已知,25℃,Ksp(Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13)
【答案】粉碎银精矿或适当增大液固比或适当提取浸取温度或适当延长浸取时间或充分搅拌 稀盐酸 AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl CS2 蒸馏 4:1 10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O 1.3×10-9
【解析】
银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)加盐酸和氯酸钾浸取,过滤,溶液中含有Zn2+、Cu2+、Pb2+,滤渣中含有S、SiO2、AgCl等;浸出液中加金属还原剂Zn,把Cu2+、Pb2+还原为单质,则试剂X为Zn,分离操作②为过滤,得到Cu和Pb、ZnCl2溶液;浸出渣含有S、SiO2、AgCl,加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,过滤,滤渣为S和SiO2,滤液为Na3[Ag(SO3)2]和NaCl,在滤液中加N2H4和NaOH,生成Ag和氮气;滤液中含有亚硫酸钠,氧化生成硫酸钠。
(1)为提高浸取率可采取的措施:进一步粉碎银精矿或适当增大液固比或适当提高浸取温度或适当延长浸取时间或充分搅拌等,Cu和Pb混合物中提取Cu可选用稀盐酸,根据金属活动性顺序表可知,Pb可与稀盐酸反应,Cu不反应,再过滤即可,故答案为:粉碎银精矿或适当增大液固比或适当提取浸取温度或适当延长浸取时间或充分搅拌;稀盐酸;
(2)步骤③加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,化学方程式为AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl,故答案为:AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl;
(3)步骤④分离出的滤渣中主要含有S和SiO2两种杂质,利用S易溶于CS2,滤渣中加入CS2,充分溶解后过滤,然后根据S和CS2的沸点不同进行蒸馏即可,故答案为:CS2;蒸馏;
(4)步骤⑤的化学反应方程式为:4Na3[Ag(SO3)2]+N2H4+4NaOH=4Ag↓+8Na2SO3+N2↑+4H2O,Na3[Ag(SO3)2]作氧化剂,N2H4作还原剂,其氧化剂和还原剂的物质的量之比为4:1,故答案为4:1;
(5)在碱性条件下用Al粉将NO3-还原成无污染的N2排放,其离子方程式为:10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O,已知,25℃,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13,可得,Ka= c(H+)·c(AlO2-)= c(H+)·1.0×10-7mol/L=1.0×10-13,
c(H+)=1.0×10-6mol/L,c(OH-)=1.0×10-8mol/L, Ksp[Al(OH)3]= c(Al3+)·c3(OH-)=1.3×10-33,c(Al3+)=1.3×10-9molL-1,故答案为10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O;1.3×10-9。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
X | Y | |
Z | W |
A.原子半径大小比较:r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的弱
D.Z的最低价单核阴离子的失电子能力比Y的强
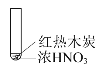
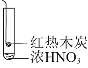
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1