题目内容
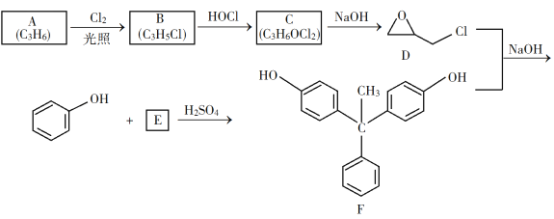
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为n![]() +(n+1)HO(CH2)4OH
+(n+1)HO(CH2)4OH![]()
![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.![]() 的沸点高于
的沸点高于![]()
B.高分子材料PU在强酸、强碱条件下能稳定存在
C.合成PU的两种单体的核磁共振氢谱中均有3组吸收峰
D.以1,![]() 丁二烯为原料,可合成
丁二烯为原料,可合成![]()
【答案】B
【解析】
A.C原子数相同时含羟基的有机物易形成氢键,沸点高,则![]() 的沸点高于
的沸点高于![]() ,故A不符合题意;
,故A不符合题意;
B.PU的结构中![]() ,酸性、碱性条件下均可发生水解反应,故不能稳定存在,故B符合题意;
,酸性、碱性条件下均可发生水解反应,故不能稳定存在,故B符合题意;
C.两种单体中均含3种不同化学环境的H原子,则两种单体的核磁共振氢谱中均有3组吸收峰,故C不符合题意;
D.以1,3-丁二烯为原料,先与溴发生1,4-加成,再与氢气加成,后发生卤代烃的水解反应可生成![]() ,故D不符合题意;
,故D不符合题意;
故答案为:B。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
X | Y | |
Z | W |
A.原子半径大小比较:r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的弱
D.Z的最低价单核阴离子的失电子能力比Y的强
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。