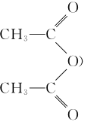
题目内容
【题目】某些共价键的键长数据如下表所示。试根据下表回答问题。
共价键 |
|
|
|
|
|
|
|
|
键长 | 0.154 | 0.134 | 0.121 | 0.143 | 0.123 | 0.146 | 0.122 | 0.110 |
(1)根据表中有关数据,你能推断出影响共价键键长的因素主要有哪些?_______。其影响的结果怎样?__________。
(2)通常,键能越__________,共价键越____,由该键构成的分子越稳定。
【答案】原子半径、原子间形成共用电子对的数目 形成相同数目的共用电子对、原子半径越小,共价键的键长越短;原子半径相同、形成共用电子对的数目越多,键长越短 大 稳定
【解析】
同是单键、双键、三键时,原子半径越小,共价键的键长越短;相同原子间单键的键长大于双键的键长大于三键的键长。
(1)根据表中数据,分析规律可知,影响因素主要是原子半径和成键类型,其原子半径、原子间形成共用电子对的数目形成相同数目的共用电子对,原子半径越小共价键的键长越短;故答案为:原子半径、原子间形成共用电子对的数目;形成相同数目的共用电子对、原子半径越小,共价键的键长越短;原子半径相同、形成共用电子对的数目越多,键长越短;
(2)键长越短,共价键不易断裂,则键能越大,形成的分子也更稳定;故答案为:大;稳定。

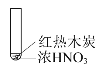
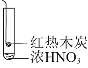
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视