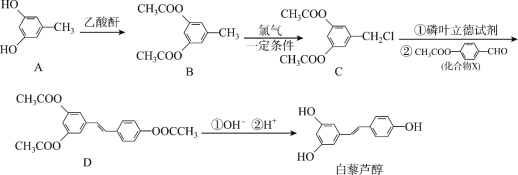
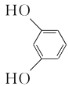
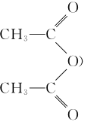
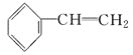
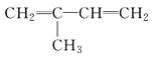题目内容
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次增强),都极易与水反应。已知![]() ,下列推测正确的是( )
,下列推测正确的是( )
A.XeF2分子中各原子均达到8电子的稳定结构
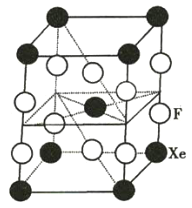
B.某种氟化氙晶体的基本结构单元如图所示,可推知其化学式为XeF6
C.XeF4与水反应时,每生成2 mol Xe转移8 mol电子
D.XeF2加入水中,在水的作用下,将生成Xe和F2
【答案】C
【解析】
A.Xe原子已经达到8电子稳定结构,故XeF2分子中各原子不可能均具有8电子稳定结构,A项错误;
B.该晶胞中Xe原子的个数为![]() ,F原子的个数为
,F原子的个数为![]() ,故该晶体的化学式为XeF2 , B项错误;
,故该晶体的化学式为XeF2 , B项错误;
C.在XeF4中Xe的化合价为+4,生成2 mol Xe转移电子8 mol,C项正确;
D.F2有强氧化性,能够与水反应,故XeF2与水反应不可能生成F2,D项错误;
答案选C。

练习册系列答案
相关题目
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。