题目内容
9.已知298K、101KPa条件下2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)是吸热反应 | |
| B. | 1 molH2O(g)转变成1 molH2O(l)放出44.0kJ热量 | |
| C. | 1 molH2O(l)转变成1 molH2O(g)放出44.0kJ热量 | |
| D. | 1 molH2O(g)转变成1 molH2O(l)放出88.0kJ热量 |
分析 已知①2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1,据盖斯定律②-①得:2H2O(l))=2H2O(g)△H=88kJ•mol-1,1mol液态水转化为气态水应吸热44KJ.
解答 解:A.H2(g)与O2(g)反应生成H2O(g)是放热反应,故A错误;
B、D.根据盖斯定律,1mol液态水转化为气态水应吸热44KJ,则1molH2O(g)转变成1molH2O(l)放出44.0kJ热量,故B正确,D错误;
C.1mol液态水转化为气态水应吸热44KJ,故C错误;
故选B.
点评 本题考查了焓变、盖斯定律、焓变与反应物生成物能量的关系,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
19.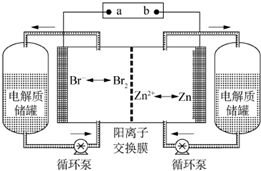 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 充电时,阳离子通过交换膜移向装置右侧 | |
| B. | 充电时,左侧与右侧的溴化锌溶液的浓度差将减小 | |
| C. | 放电时装置发生的总反应为:Zn+Br2═ZnBr2 | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
20.已知一种c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈碱性,生成的盐可能是( )
| A. | 强酸强碱盐 | B. | 强酸弱碱盐 | ||
| C. | 强碱弱酸盐 | D. | 上述三种盐均可能 |
17.下列叙述中正确的是( )
| A. | H3O和OH-中具有相同的质子数和电子数 | |
| B. | 中子数为20的氯原子可表示为${\;}_{17}^{20}$Cl | |
| C. | 23592U 和23892U 是同位素,物理性质几乎相同,化学性质不同 | |
| D. | S2-的结构示意图 |
14.下列叙述中,你认为科学的是( )
| A. | 在地球上分布很广,淡水资源取之不尽,用之不竭 | |
| B. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 | |
| C. | 某广告语:本饮料纯属天然物质,不含任何化学成分 | |
| D. | 到城乡结合处燃放鞭炮,可避免污染环境 |
1.分离和提纯下列混合物,将合理的方法填入下列空格内:
常见的物质分离和提纯的方法有:过滤,蒸发,升华,萃取,蒸馏,加热分解,结晶等.
| 序号 | 混合物 | 方法 |
| 1 | 海水中提取饮用水 | |
| 2 | 提取碘水中的碘 | |
| 3 | 从含少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| 4 | 从KNO3溶液中分离AgCl颗粒; | |
| 5 | 除去生石灰中混有少量的碳酸钙 |
18.下列物质中属于电解质的是( )
| A. | 稀硫酸 | B. | 钠 | C. | NH4Cl | D. | 酒精 |
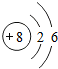 ;
;