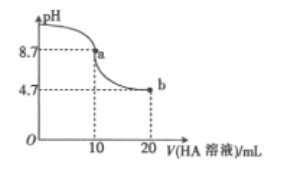
题目内容
【题目】由X、Y和Z合成缓释药物M,下列说法不正确的是
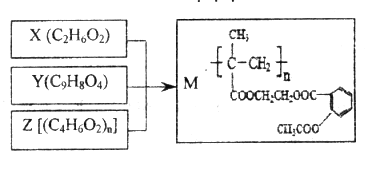
A. M在体内能缓慢发生水解反应
B. X可以由乙烯通过加成反应和取代反应制各
C. 1molY与NaOH溶液反应,最多能消耗3mol NaOH
D. Z由加聚反应制得,其单体的结构简式是CH3CH=CHCOOH
【答案】D
【解析】
A. M中含有酯基,在体内能缓慢发生水解反应,故A正确;B. M水解的产物为邻羟基苯甲酸、乙酸、乙二醇和2-甲基丙烯酸,则X为乙二醇,可以由乙烯与溴加成后水解得到,故B正确;C.Y为邻羟基苯甲酸和乙酸酯化得到的酯,1mol Y与NaOH溶液反应,最多能消耗3mol NaOH,故C正确;D. Z由2-甲基丙烯酸通过加聚反应制得,其单体的结构简式是CH2=C (CH3)COOH,故D错误;故选D。

练习册系列答案
相关题目