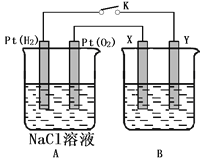
题目内容
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
【答案】A
【解析】由题可知,向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,CH3COOH先和NaOH反应生成CH3COONa,过程中离子浓度降低,导电率降低,故A点时,NaOH被完全反应完,导电率最低,然后,CH3COOH和NH3·H2O反应生成CH3COONH4,使离子浓度增大,导电率增大,故B点时,NH3·H2O反应完全,B点以后,再加入CH3COOH溶液,溶液体积增大,离子浓度下降,导电率下降。A、a=20,b=40,A点时溶质为:CH3COONa、NH3·H2O,B点时,溶质为:CH3COONa 、CH3COONH4,均为碱性,故且溶液呈中性不在A、B两点之间,故A错误;B、B点时,溶液为等浓度的CH3COONa 、CH3COONH4混合溶液,故离子浓度大小为:c(CH3COO-)>c(Na+)>c(NH![]() ),故B正确;C、C点时,溶液是等浓度的CH3COONa、CH3COONH4、CH3COOH溶液,C、c(H+)=
),故B正确;C、C点时,溶液是等浓度的CH3COONa、CH3COONH4、CH3COOH溶液,C、c(H+)=![]() c(CH3COO-)/c(CH3COOH)
c(CH3COO-)/c(CH3COOH)![]() 2,c(H+)
2,c(H+)![]() 故pH≈5,故C正确;D、AB两点均是水解促进水的电离,且B点促进程度更大,故B点溶液中水的电离程度最大,故D正确;故选A。
故pH≈5,故C正确;D、AB两点均是水解促进水的电离,且B点促进程度更大,故B点溶液中水的电离程度最大,故D正确;故选A。