题目内容
16.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.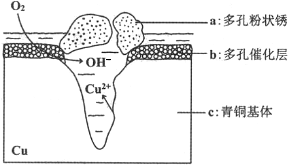
(1)原子序数为29的铜元素位于元素周期表中第四周期.
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为10:1.
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl.关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是AB.
A.降低了反应的活化能 B.增大了反应的速率
C.降低了反应的焓变 D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀.如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为Ag2O+2CuCl=2AgCl+Cu2O.
(5)如图为青铜器在潮湿环境中发生的电化学腐蚀的原理示意图.
①腐蚀过程中,负极是c(填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
分析 (1)原子核外电子层数与其周期数相等,Cu原子核外有4个电子层;
(2)Sn、Pb的物质的量之比=$\frac{119g}{119g/mol}$:$\frac{20.7g}{207g/mol}$=1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比;
(3)A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关;
(4)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物;
(5)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
③n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)原子核外电子层数与其周期数相等,Cu原子核外有4个电子层,所以Cu元素位于第四周期,故答案为:四;
(2)Sn、Pb的物质的量之比=$\frac{119g}{119g/mol}$:$\frac{20.7g}{207g/mol}$=1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比,所以Sn、Pb原子个数之比为10:1,故答案为:10:1;
(3)A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,故B正确;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故选AB;
(4)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,
反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,
故答案为:Ag2O+2CuCl=2AgCl+Cu2O;
(5)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448.
点评 本题考查较综合,侧重考查学生自身综合应用及计算能力,涉及氧化还原反应计算、离子方程式及复分解反应方程式的书写、原电池原理、催化剂的作用等知识点,利用原电池原理、物质性质及转移电子守恒进行解答,易错点是(3)题,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出c(H+)大于HCN中水电离出的c(H+) | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 向2.0 mL浓度均为0.1 mol•L-1 的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH>7 | |
| C. | 物质的量浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| D. | 能使石蕊试液变红的溶液中,Fe2+、Na+、NO3-、Cl-能大量存在 |
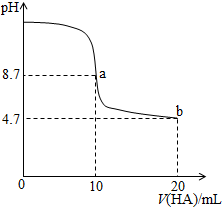
| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用磨口玻璃瓶保存NaOH溶液 | ||
| C. | 稀硝酸可除去试管内壁的银镜 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
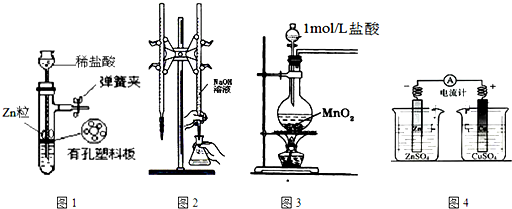
| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |


