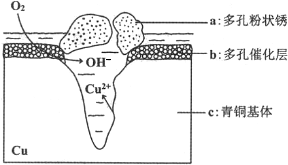
题目内容
7.写出下列聚合物的单体和它们的聚合反应方程式.(1)
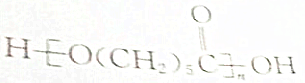
(2)

(3)
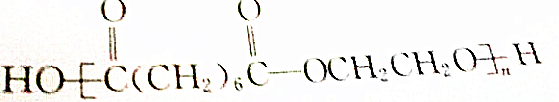
分析 首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断,
(一)加聚产物的单体推断方法:凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体,凡链节中主碳链为6个碳原子,含有碳碳双键结构,单体为两种(即单烯烃和二烯烃).
(1)凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
(2)凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体;
(3)凡链节中主碳链为6个碳原子,含有碳碳双键结构,单体为两种(即单烯烃和二烯烃);
(二)缩产物的单体推断方法:断键,补原子,即找到断键点,断键后在相应部位加上-OH或-H.
解答 解:(1) ,该高分子化合物为缩聚产物,将中括号去掉,然后添上羟基-OH和O原子即可得到其单体:HO(CH2)5COOH,
,该高分子化合物为缩聚产物,将中括号去掉,然后添上羟基-OH和O原子即可得到其单体:HO(CH2)5COOH,
反应方程式为:nHO(CH2)5COOH$\stackrel{一定条件}{→}$ +(n-1)H2O,
+(n-1)H2O,
故答案为:HO(CH2)5COOH,nHO(CH2)5COOH$\stackrel{一定条件}{→}$ +(n-1)H2O;
+(n-1)H2O;
(2)凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,所以该高分子化合物为加聚产物,将中括号去掉,然后补上双键,
得到其单体:CH2=CHCONH2,反应方程式为:nCH2=CHCONH2$\stackrel{一定条件}{→}$ ,
,
故答案为:CH2=CHCONH2,nCH2=CHCONH2$\stackrel{一定条件}{→}$ ;
;
(3) ,该高分子化合物为缩聚产物,将中括号去掉,然后添上羟基-OH和O原子即可得到其单体:HOOC(CH2)6COCH2CH2OH,
,该高分子化合物为缩聚产物,将中括号去掉,然后添上羟基-OH和O原子即可得到其单体:HOOC(CH2)6COCH2CH2OH,
反应方程式为:nHOOC(CH2)6COCH2CH2OH$\stackrel{一定条件}{→}$ +nH2O,
+nH2O,
故答案为:HOOC(CH2)6COCH2CH2OH、nHOOC(CH2)6COCH2CH2OH$\stackrel{一定条件}{→}$ +nH2O.
+nH2O.
点评 本题考查了缩聚、加聚反应原理、高分子化合物单体的书写,题目难度不大,注意掌握缩聚反应类型及反应原理,能够根据缩聚反应产物正确书写其单体.

| X | Y | |
| Z | ||
| T |
| A. | 原子半径:T>W>Z | |
| B. | 元素T与X的原子序数相差15 | |
| C. | T、Z、W三种元素的最高价氧化物对应的水化物的酸性依次减弱 | |
| D. | X、W两元素的氢化物的浓溶液相互靠近时有白烟产生 |
| A. | 1 L 1 mol•L-1的醋酸溶液中含有的醋酸分子数为NA | |
| B. | 电解精炼铜时,当阳极上质量减少6.4 g时,电路中转移的电子数为2NA | |
| C. | 常温下,46 g NO2和N2O4的混合物中含有的氧原子数为2NA | |
| D. | 11.2 L CO2中含有的分子数为0.5NA |
| A. | 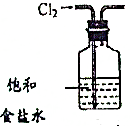 用图1装置除去HCl中少量的Cl2 | |
| B. | 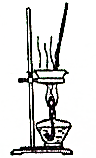 用图2装置蒸干Al2(SO4)3饱和溶液制取无水Al2(SO4)3 | |
| C. |  图3制备并收集少量NO2 | |
| D. | 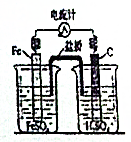 图4是原电池装置,Fe电极为阴极 |
| A. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 元素非金属性由强到弱的顺序:Z、W、X | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
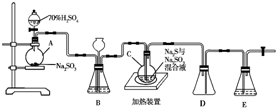 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下: (1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.
(1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.