题目内容
11.室温下,下列有关溶液的说法正确的是( )| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH>7 | |
| C. | 物质的量浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| D. | 能使石蕊试液变红的溶液中,Fe2+、Na+、NO3-、Cl-能大量存在 |
分析 A、根据弱电解质的电离平衡来分析稀释后的pH;
B、醋酸为弱酸,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L;
C、混合溶液体积增大一倍,所以浓度降为原来的一半,根据物料守恒来分析;
D、使紫色石蕊试液变红的溶液为酸性.
解答 解:A、因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故A错误;
B、醋酸为弱电解质,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),即pH<7,故B错误;
C、混合溶液体积增大一倍,所以浓度降为原来的一半,即混合后得浓度均为0.005 mol•L-1的CH3COOH和CH3COONa的混合溶液,根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.01mol•L-1,故C正确;
D、使紫色石蕊试液变红的溶液为酸性,Fe2+、NO3-发生氧化还原反应,则不能共存,故D错误.
故选C.
点评 本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,明确醋酸为弱电解质为解答关键,注意掌握酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
1.用糖类物质制备乙酸乙酯的合成路线之一如图所示:
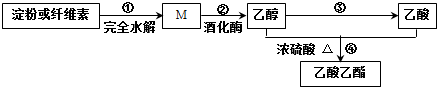
下列说法正确的是( )

下列说法正确的是( )
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 反应②:1 mol M可生成3 mol CH3CH2OH | |
| C. | 反应③:所需反应条件可为酸性重铬酸钾溶液 | |
| D. | 反应④:产物通入滴有酚酞的饱和碳酸钠溶液中振荡、静置后下层溶液颜色无变化 |
3.化学与生活密切相关.下列应用中利用了物质氧化性的是( )
| A. | 明矾净化水 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 漂白粉漂白织物 |
20.下列物质的结构或性质与氢键无关的是( )
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 | ||
| C. | 氢化镁的晶格能 | D. | DNA的双螺旋结构 |
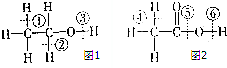 (1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.
(1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.
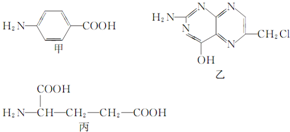 叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.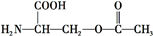 .
.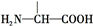
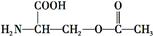 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.