题目内容
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
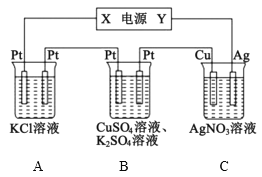
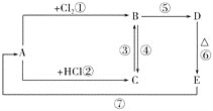
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
【答案】B Cl2+Na2S=2NaCl+S↓ ①② 蓝色 Cl与I同主族,且Cl在I的上方,同主族元素,从上到下,非金属性依次减弱,则非金属性Cl>I
【解析】
(1)验证氯元素的非金属性比硫强,可通过置换反应、强酸制弱酸的反应等进行判断,装置A中盛放的试剂是Na2S溶液;
(2)①HCl的溶解度比H2S大,溶解度是物理性质,不能比较非金属性强弱;
②HCl的酸性比H2S强,氢化物酸性不能比较非金属性强弱,如HF是弱酸、HCl是强酸,但非金属性F>Cl;
③HCl的稳定性比H2S大,则表明前者共价键比后者难断裂;
④HCl的还原性比H2S弱,表明前者Cl的失电子能力比S弱,则得电子能力比S强;
⑤HClO4的酸性比H2SO4强,则非金属性Cl比S强;
⑥还原性:Cl- <S2-,表明前者Cl-的失电子能力比S2-弱,则得电子能力比S强;
⑦Cl2能与H2S反应生成S,Cl2为氧化剂,S为氧化产物,则非金属性Cl>S;
⑧在周期表中Cl处于S同周期的右侧,同周期元素,从左往右,非金属性依次增强,则非金属性Cl>S;
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,装置A中生成I2,与淀粉发生显色反应。用元素周期律理论解释非金属性Cl>I,二者同主族,且Cl在I的上方。
(1)验证氯元素的非金属性比硫强,可通过置换反应,装置A中盛放的试剂是B;化学反应方程式为Cl2+Na2S=2NaCl+S↓;
(2)①HCl的溶解度比H2S大,溶解度是物理性质,不能比较非金属性强弱,①符合题意;
②HCl的酸性比H2S强,氢化物酸性不能比较非金属性强弱,如HF是弱酸、HCl是强酸,但非金属性F>Cl,②符合题意;
③HCl的稳定性比H2S大,则表明前者共价键比后者难断裂,从而说明Cl的非金属性比S强,③不合题意;
④HCl的还原性比H2S弱,表明前者Cl的失电子能力比S弱,则得电子能力Cl比S强,④不合题意;
⑤HClO4的酸性比H2SO4强,则非金属性Cl比S强,⑤不合题意;
⑥还原性:Cl-<S2-,表明前者Cl-的失电子能力比S2-弱,则得电子能力Cl比S强,⑥不合题意;
⑦Cl2能与H2S反应生成S,Cl2为氧化剂,S为氧化产物,则非金属性Cl>S,⑦不合题意;
⑧在周期表中Cl处于S同周期的右侧,同周期元素,从左往右,非金属性依次增强,则非金属性Cl>S,⑧不合题意。
则不能用于验证氯元素比硫元素非金属性强的依据为①②;答案为:①②;
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,装置A中生成I2,与淀粉发生显色反应,溶液显蓝色。用元素周期律理论解释非金属性Cl>I的原因:Cl与I同主族,且Cl在I的上方,同主族元素,从上到下,非金属性依次减弱,则非金属性Cl>I。

【题目】有关元素X、Y、D、E的信息如下:
元素 | 有关信息 |
X | 地壳中含量最高的元素 |
Y | 第三周期中原子半径最小的元素 |
D | 最高价氧化物既能溶于强酸又能溶于强碱 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)D在元素周期表中的位置为____。
(2)X、Y、D形成的简单离子的半径由大到小为_____。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的单质溶于强碱的离子方程式为________。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_____。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体