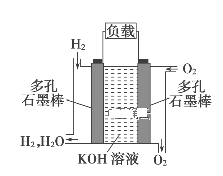
题目内容
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。下列说法错误的是( )
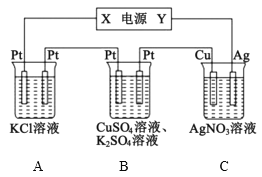
A.电源中X电极为直流电源的负极
B.pH变化:A:增大,B:减小,C:不变
C.通电5min时,B中共收集224mL(标准状况下)气体,该气体是氧气
D.若A中KCl足量且溶液的体积为200mL,则电解后,溶液的pH为13(假设电解前后溶液体积无变化)
【答案】C
【解析】
A.根据图示,由铜电极的质量增加,发生Ag++e-=Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故A正确;
B.A中电解氯化钾得到氢氧化钾溶液,pH增大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-=Ag,阳极反应为Ag-e-=Ag+,溶液浓度不变,则pH不变, pH变化:A:增大,B:减小,C:不变,故B正确;
C.C中阴极反应为Ag++e-=Ag,n(Ag)=![]() =0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,标况下其体积为0.005mol×22.4L/mol=0.112L=112mL,由2H++2e-=H2↑,则氢气的物质的量为0.005mol,则在阴极也生成标况下112mL氢气,通电5min时,B中共收集224mL(标准状况下)气体,该气体是氢气和氧气,故C错误;
=0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,标况下其体积为0.005mol×22.4L/mol=0.112L=112mL,由2H++2e-=H2↑,则氢气的物质的量为0.005mol,则在阴极也生成标况下112mL氢气,通电5min时,B中共收集224mL(标准状况下)气体,该气体是氢气和氧气,故C错误;
D.由A中发生2KCl+2H2O![]() 2KOH+H2↑+Cl2↑,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=
2KOH+H2↑+Cl2↑,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=![]() =0.1molL-1,c(H+)=
=0.1molL-1,c(H+)=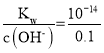 molL-1=10-13 molL-1,溶液pH=13,故D正确;
molL-1=10-13 molL-1,溶液pH=13,故D正确;
答案选C。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |