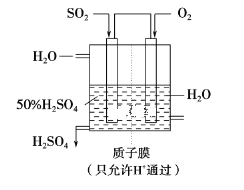
题目内容
【题目】下面是元素周期表的简略框架图。
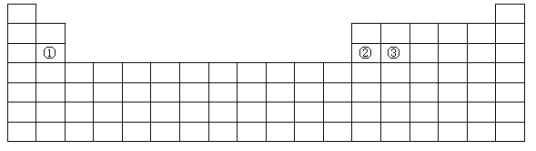
(1)在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是____(填元素符号)。
(2)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中______族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实______________________。
(3)比较上表中元素①与元素②的下列性质(填写“>”或“<”)。电负性:①_____②;第一电离能:①____________②。
(4)某短周期元素最高正价为+7,其原子结构示意图为__________________。
(5)基态原子③中,电子占据的最高能层符号_____,该能层具有的原子轨道数为____。
【答案】B Si As Te IVA H原子得到一个电子实现最外电子层稳定结构 < > 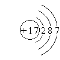 M 9
M 9
【解析】
(1)金属与非金属的分界线是非金属元素的硼、硅、砷、啼、砹与金属元素铝、锗、锑、钋之间的分界线,在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是B、Si、 As、Te。
答案为:B Si As Te;
(2)最高正价与最低负价绝对值相等的族为ⅣA族;氢原子得到1个电子达到稳定结构,这一特点同ⅦA族元素相同。
答案为:IVA;H原子得到一个电子实现最外电子层稳定结构;
(3)由①和②在周期表中的位置可确定①、②分别为Mg和Al,其价电子排布式分别为3s2和3s23p1。利用同周期元素的递变规律可知:原子半径:Mg>Al,金属性:Mg>Al,电负性:Al>Mg,根据价层电子排布式镁更稳定,第一电离能Mg>Al
答案为:<;>;
(4)因短周期元素最高正价为+7的元素应为ⅦA族元素,氟元素无正价,所以该元素为氯元素。其原子结构示意图为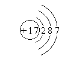 。
。
答案为: ;
;
(5)基态原子③为Si元素,核外电子排布式为1s22s22p63s23p2,电子占据的最高能层符号M,该能层含有s、p、d能级,分别含有的轨道数为1、3、5,具有的原子轨道数为9。
答案为:M;9

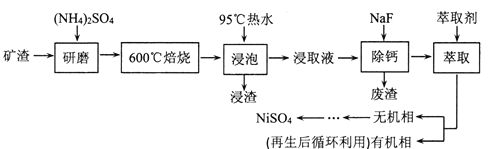
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
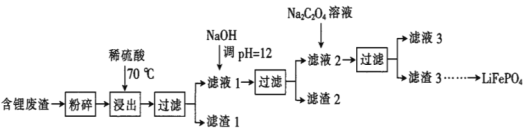
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
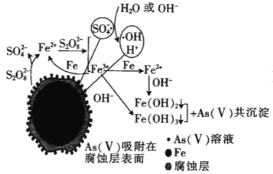
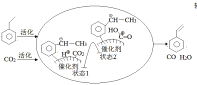
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。