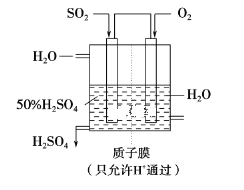
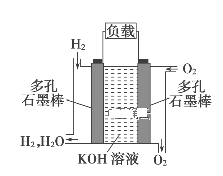
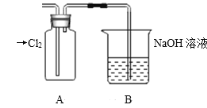
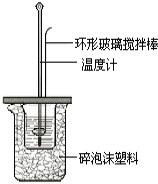
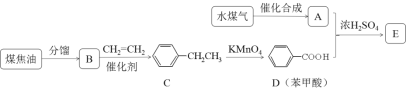
题目内容
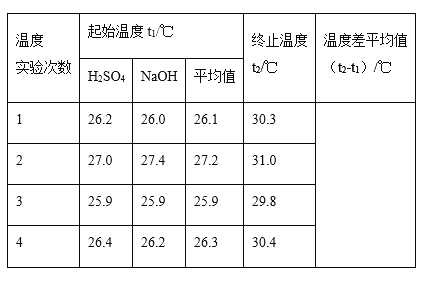
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
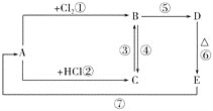
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
【答案】Fe Fe2O3 2FeCl2+Cl2=2FeCl3 FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3) 出现白色沉淀,迅速变成灰绿色,最终变成红褐色
2Fe+Al2O3) 出现白色沉淀,迅速变成灰绿色,最终变成红褐色
【解析】
D是一种红褐色沉淀,应为Fe(OH)3,由转化关系可知E为Fe2O3,A为Fe,则B为FeCl3,C为FeCl2,结合对应物质的性质以及题目要求解答该题。
(1)由以上分析可知A为Fe,E为Fe2O3,
故答案为:Fe;Fe2O3;
(2)C为FeCl2,可与氯气反应生成FeCl3,方程式为2FeCl2+Cl2=2FeCl3,B为FeCl3,可与氢氧化钠溶液反应生成Fe(OH)3,方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,可经一氧化碳高温下还原(或铝热反应)生成Fe,方程式为Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3),
2Fe+Al2O3),
故答案为:2FeCl2+Cl2=2FeCl3;FeCl3+3NaOH=Fe(OH)3↓+3NaCl;Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3);
2Fe+Al2O3);
(3)C为FeCl2,可与氢氧化钠溶液反应生成Fe(OH)2,出现白色沉淀,Fe(OH)2不稳定已被空气中的氧气氧化,迅速变成灰绿色,最终变成红褐色,
故答案为:出现白色沉淀,迅速变成灰绿色,最终变成红褐色。

【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |