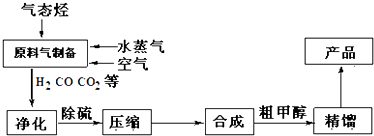
题目内容
1.下列叙述不正确的是( )| A. | 随着碳原子数的增加,烷烃的熔、沸点升高 | |
| B. | 在有机物中,碳原子通过四个共价键与其它原子结合 | |
| C. | 甲烷、乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 烷烃在光照下与氯气发生取代反应 |
分析 A、烃类的沸点与分子间作用力有关,随相对分子质量的增大,分子间作用力增大,沸点升高;
B、碳原子能与多种原子形成四个共价键(碳和碳之间可以形成双键,可以是单键,可以是叁键),且碳原子之间相互成键可以成碳链,可以成碳环;
C、甲烷不能使酸性高锰酸钾溶液褪色;
D、烷烃的通性是饱和碳原子上的氢原子在一定条件下和氯气发生取代反应.
解答 解:A、烃类的沸点与分子间作用力有关,随相对分子质量的增大,分子间作用力增大,沸点升高,烷烃也符合此规律,故A正确;
B、碳原子能与多种原子形成四个共价键(碳和碳之间可以形成双键,可以是单键,可以是叁键),且碳原子之间相互成键可以成碳链,可以成碳环,所以在有机物中,碳原子通过四个共价键与其它原子结合,故B正确;
C、甲烷不能使酸性高锰酸钾溶液褪色,故C错误;
D、烷烃的通性是饱和碳原子上的氢原子在一定条件下和氯气发生取代反应,所以烷烃在光照条件下都能与氯气发生取代反应,故D正确;
故选C.
点评 本题考查了烷烃的结构特征,化学性质的应用,取代反应等,较简单,掌握基础便可解决.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.如图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
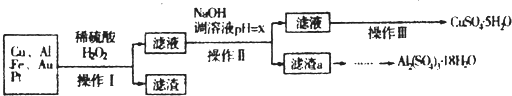
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.
16.利用金属活动性的不同,可以采用不同的冶炼方法.下面关于金属冶炼叙述正确的是( )
| A. | 高炉炼铁采用了热分解法 | |
| B. | 电解氯化钠溶液冶炼金属钠 | |
| C. | 依据Fe+CuSO4═FeSO4+Cu的原理冶炼金属铜 | |
| D. | 金属冶炼的实质是将金属元素从其化合物中氧化出来 |
13.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 78g苯中含有碳碳双键数目为3NA | |
| B. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| C. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子总数为3NA | |
| D. | 50mL12mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数小于0.3NA |
10.常温下,把10mL2mol•L-1的氢氧化钠溶液分别加到4个盛有不同体积、不同浓度的醋酸溶液的烧杯中,丙加水稀释到50mL,其中反应速率最大的是( )
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
11.可以把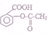 转变成
转变成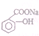 的方法是( )
的方法是( )
 转变成
转变成 的方法是( )
的方法是( )| A. | 加入足量的NaOH(aq)并加热 | |
| B. | 与盐酸共热后,再加入足量的NaOH溶液 | |
| C. | 与足量NaOH溶液共热后,再通入足量CO2 | |
| D. | 与稀硫酸共热后,加入足量Na2CO3溶液 |