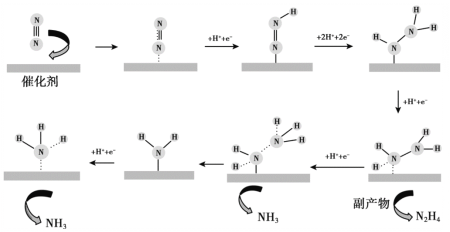
题目内容
【题目】现有反应:①NaOH+HCl=NaCl+H2O, ②Fe+H2SO4=FeSO4+H2↑。
回答下列问题:
(1)两反应中属于氧化还原反应的是_____(填序号,下同),能设计成原电池的是___。
(2)Fe—Cu原电池的装置如图所示。
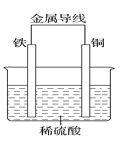
①铁作_____(填“正极”或“负极”),溶液中H+向____(填“铁”或“铜”)电极方向移动。
②正极的现象是________,负极的电极反应式为________。
【答案】② ② 负极 铜 有气泡产生 Fe—2e—=Fe2+
【解析】
(1)NaOH+HCl=NaCl+H2O为非氧化还原反应,无化合价变化,不能设计成原电池,Fe+H2SO4=FeSO4+H2↑是氧化还原反应,可设计成原电池,所以两反应中属于氧化还原反应的是②,能设计成原电池的是②,本题答案为:②;②;
(2)①Fe—Cu原电池中,铁为负极,铜为正极,溶液中氢离子向正极移动,本题答案为:负极;铜;
②正极发生还原反应,现象是有气泡产生,负极的电极反应为Fe—2e—=Fe2+,本题答案为:有气泡产生;Fe—2e—=Fe2+;

 阅读快车系列答案
阅读快车系列答案【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

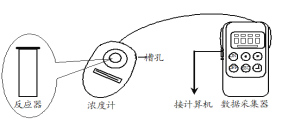
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
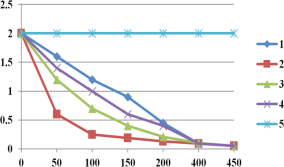
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。