题目内容
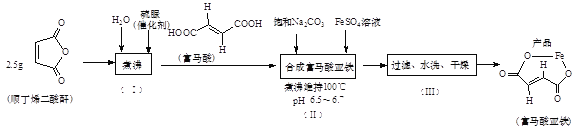
【题目】有机物Q是有机合成的重要中间体,制备Q的一种合成路线如下(部分反应条件和试剂略去)。
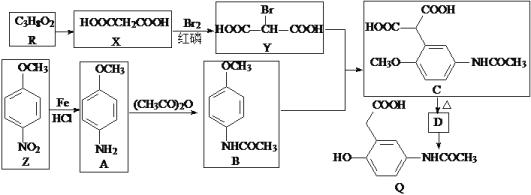
回答下列问题:
(1)Y中不含氧的官能团名称为__________,R的名称为_________________________。
(2)加热C脱去CO2生成D,D的结构简式为____________________________。
(3)B+Y→C的反应类型是_______________,Q的分子式为____________________。
(4)A→B的化学方程式为______________________________________________。
(5)同时满足下列条件的Z的同分异构体有_____________种(不包括立体异构)。①能与氯化铁溶液发生显色反应;②能与碳酸氢钠反应;③含―NH2; ④苯环上有处于对位的取代基
(6)已知:―NH2具有强还原性。参照上述合成路线,以![]() 为原料(无 机试剂任选),设计制备
为原料(无 机试剂任选),设计制备![]() 的合成路线:__________。(格式:CH2=CH2
的合成路线:__________。(格式:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
【答案】溴原子 1,3-丙二醇 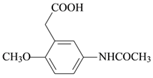 取代反应 C10H11O4N
取代反应 C10H11O4N  6
6 
【解析】
由R的分子式、X的结构简式,可推知R为HOCH2CH2CH2OH;加热C脱去CO2生成D,即C中侧链-CH(COOH)2转化为-CH2COOH而得到D,因此D为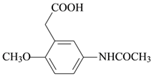 ,结合官能团的结构和性质分析解答(1)~(5)。
,结合官能团的结构和性质分析解答(1)~(5)。
(6)由于-NH2具有强还原性,应先引入羧基,再还原硝基得到氨基,因此应先制备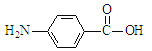 结合羟基的引入方法分析解答。
结合羟基的引入方法分析解答。
(1)Y(![]() )中含有的官能团有-COOH、-Br,其中不含氧的官能团为溴原子;由R的分子式、X的结构简式,可推知R为HOCH2CH2CH2OH,名称为:1,3-丙二醇,故答案为:溴原子;1,3-丙二醇;
)中含有的官能团有-COOH、-Br,其中不含氧的官能团为溴原子;由R的分子式、X的结构简式,可推知R为HOCH2CH2CH2OH,名称为:1,3-丙二醇,故答案为:溴原子;1,3-丙二醇;
(2)加热C脱去CO2生成D,即C中侧链-CH(COOH)2转化为-CH2COOH而得到D,故D的结构简式为: ,故答案为:
,故答案为: ;
;
(3)对比B、Y、C的结构,可知B中苯环上-OCH3邻位的H原子被换成了-CH(COOH)2生成C,属于取代反应。Q(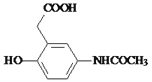 )的分子式为:C10H11O4N,故答案为:取代反应;C10H11O4N;
)的分子式为:C10H11O4N,故答案为:取代反应;C10H11O4N;
(4)对比A、B结构,可知A→B是A的氨基中氢原子被![]() 取代生成B,同时还生成CH3COOH,反应的方程式为:
取代生成B,同时还生成CH3COOH,反应的方程式为: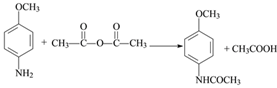 ,故答案为:
,故答案为: ;
;
(5)Z为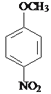 ,Z的同分异构体满足:①能与氯化铁溶液发生显色反应,说明含有酚羟基;②能与碳酸氢钠反应,说明含有-COOH;③含-NH2,④苯环上有处于对位的取代基,该同分异构体中含有3个取代基:-OH、-NH2、-COOH,处于对位的2个取代基有3种组合,另外一个取代基均含有2种位置,故符合条件的共有3×2=6种,故答案为:6;
,Z的同分异构体满足:①能与氯化铁溶液发生显色反应,说明含有酚羟基;②能与碳酸氢钠反应,说明含有-COOH;③含-NH2,④苯环上有处于对位的取代基,该同分异构体中含有3个取代基:-OH、-NH2、-COOH,处于对位的2个取代基有3种组合,另外一个取代基均含有2种位置,故符合条件的共有3×2=6种,故答案为:6;
(6)以![]() 为原料制备
为原料制备![]() 。氨基可以有硝基还原得到,由于-NH2具有强还原性,应先引入羧基,因此应先制备
。氨基可以有硝基还原得到,由于-NH2具有强还原性,应先引入羧基,因此应先制备 ,再还原硝基得到氨基,
,再还原硝基得到氨基,在碱性条件下溴原子水解可以引入羟基,再氧化可以引入-COOH,最后与Fe/HCl作用,还原得到氨基,合成路线流程图为:
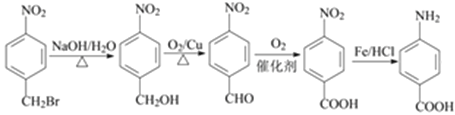 ,故答案为:
,故答案为: 。
。

 智慧小复习系列答案
智慧小复习系列答案【题目】实验小组制备高铁酸钾![]() 并探究其性质。
并探究其性质。
资料:![]() 为紫色固体,微溶于
为紫色固体,微溶于![]() 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
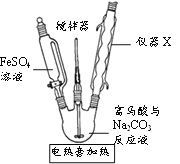
(1)制备![]() (夹持装置略)
(夹持装置略)
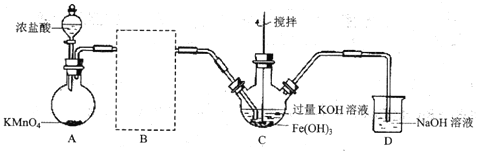
①A为氯气发生装置。A中反应的离子方程式为_________(锰被还原为![]() )。
)。
②请在B方框内将除杂装置补充完整,并标明所用试剂__________。
③![]() 中得到紫色固体和溶液。
中得到紫色固体和溶液。![]() 中主要反应的化学方程式为___________。
中主要反应的化学方程式为___________。
(2)探究![]() 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有![]() 。为证明是否
。为证明是否![]() 氧化了
氧化了![]() 而产生
而产生![]() ,设计以下方案:
,设计以下方案:
方案Ⅰ | 取少量a,滴加 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 |
由方案Ⅰ中溶液变红可知a中含有的离子为____,但该离子的产生不能判断一定是![]() 将
将![]() 氧化,该离子还可能由_______产生(用离子方程式表示)。
氧化,该离子还可能由_______产生(用离子方程式表示)。
②根据![]() 的制备实验得出:氧化性
的制备实验得出:氧化性___________
![]() (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明,![]() 和
和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() ,验证实验如下:将溶液
,验证实验如下:将溶液![]() 滴入
滴入![]() 和足量
和足量![]() 的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______________。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______________。