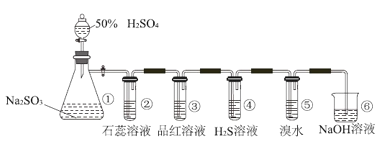
题目内容
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO![]() =Cu2++ 2NO2↑+ 2H2O
=Cu2++ 2NO2↑+ 2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D.自来水中通入Cl2可以杀菌消毒:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
【答案】B
【解析】
A.氯气具有强氧化性,Fe2+具有还原性,Fe3+显黄色,所以向FeCl2溶液中通入氯气,发生2Fe2++ Cl2= 2Fe3++ 2Cl-反应,溶液变为黄色,故A正确;
B.硝酸具有强氧化性,向铜粉中滴加稀硝酸,会产生NO气体,其反应的离子方程式为:3Cu + 8H++ 2NO![]() =3Cu2++ 2NO↑+ 4H2O,故B错误;
=3Cu2++ 2NO↑+ 4H2O,故B错误;
C.向CuSO4溶液中滴加NaOH溶液,会产生蓝色沉淀Cu(OH)2,其反应的离子方程式为:Cu2++ 2OH-=Cu(OH)2↓,故C正确;
D.自来水中通入Cl2可以杀菌消毒,因为氯气与水反应生成了强氧化性的次氯酸,反应的离子方程式为:Cl2+H2O![]() H++Cl-+HClO,故D正确;
H++Cl-+HClO,故D正确;
故答案:B。

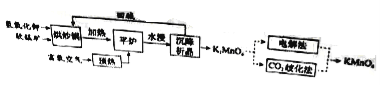
【题目】连二亚硫酸钠(Na2S2O4)是印刷行业重要的还原剂,易溶于水,难溶于乙醇;高铁酸钾(K2FeO4)是一种绿色环保型饮用水处理剂。某课题小组拟以硫铁矿(主要成分是FeS2)为主要原料制备连二亚硫酸钠和高铁酸钾,其简易工艺流程如下(部分步骤和条件略去):
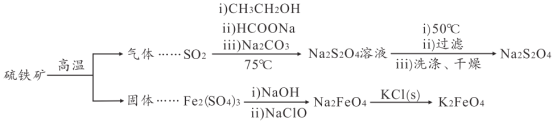
(1)FeS2中含有S22-离子,其电子式为_____。“气体”的主要成分是O2、SO2和N2,参考表中的数据,简述工业上用物理方法分离提纯二氧化硫的实验方案:_____
熔点/℃ | 沸点/℃ | 密度/gL-1(标准状况) | |
O2 | -218 | -183 | 1.429 |
SO2 | -76 | -10 | 2.9 |
N2 | -210 | -196 | 1.25 |
(2)SO2→Na2S2O4步骤中氧化剂与还原剂的物质的量之比为_____。制得的Na2S2O4溶液冷却至50℃,过滤,用_____洗涤,干燥,制得Na2S2O4。
(3)Na2FeO4与KC1发生复分解反应制备K2FeO4,说明相同温度下K2FeO4的溶解度_____(填“ > ”、“ < ”或=”) Na2FeO4的溶解度。
(4)溶液中的Na2S2O4易被空气中的氧气氧化生成NaHSO3,反应的离子方程式为_____
(5)在制备Na2FeO4时,现象是先生成红褐色沉淀,随后转化成绿色溶液,生成了 Na2FeO4。
①写出红褐色沉淀转化为Na2FeO4的化学方程式:_____。
②为探究Na2FeO4和Cl2的氧化性相对强弱,取少量上述绿色溶液于试管中,滴加适量浓盐酸,产生能使湿润的KI淀粉试纸变蓝色的气体,不能说明Na2FeO4的氧化性比Cl2的氧化性强,理由是_____。