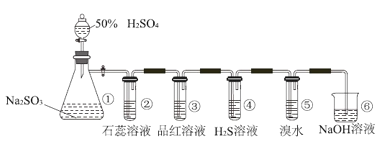
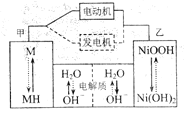
��Ŀ����
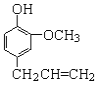
����Ŀ��Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ��ǻ����ɻ��IJ�������ҺpH��С�йء������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����̣�

��ͼ��ʾװ�ý������±���ʾ��ʵ�飬����p-CP�ij�ʼŨ����ͬ������ʵ���������±���������¶Ա�ʵ�飬���ղ�������p-CPŨ�ȵĸı�����
��ʵ�����ݣ�
ʵ���� | H2O2��Һ | Fe2+��Һ | ����ˮ | pH | �¶� | ||
c/(10-3mol��L-1) | V/mL | c/(10-3mol��L-1) | V/mL | V/mL | T/K | ||
�� | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
�� | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
�� | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
�� | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
�� | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
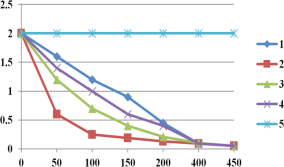
ͼ2ʵ����p-CP��Ũ����ʱ��ı仯
����������ͣ�
(1)ʵ����У�x=________��
(2)ʵ��١��ݵ�Ŀ����________��
(3)ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ����Ƿ������½��ⷴӦ���ʼ��٣���Fenton�������Լ�H2O2���ʵĽǶȷ���ԭ��_____(���û�ѧ������)��
(4)ͨ��ʵ��ݿ��Եó���������pH����10ʱ�����ⷴӦ����ֹͣ���Ʋ���ܵ�ԭ��__��
���𰸡�8 ̽��pH��P-CP�������ʵ�Ӱ�� �¶ȸ�H2O2�ֽ�![]() pH=10ʱ�� Fe2+��H2O2��Ӧ���ɵ�Fe(OH)3�������ý��ͣ��������ǻ����ɻ������ģ�����������������Ⱦ��
pH=10ʱ�� Fe2+��H2O2��Ӧ���ɵ�Fe(OH)3�������ý��ͣ��������ǻ����ɻ������ģ�����������������Ⱦ��
��������
ʵ���Ϊ�����飬ʵ�����̽���¶ȶԽ������ʵ�Ӱ�죬ʵ��ۡ�����̽��Ũ�ȶԽ������ʵ�Ӱ�죬ʵ�����̽��pH�Խ������ʵ�Ӱ�졣
(1)ʵ���Ϊ�����飬ʵ�����̽���¶ȶԽ������ʵ�Ӱ�죬ʵ�����̽��Ũ�ȶԽ������ʵ�Ӱ�죬Ӧ���ֵ�һ��������Һ�����ӦΪ15mL����x=8�������Ϊ��8��
(2)ʵ��١��������Լ��������Ũ�Ⱦ���ͬ��ֻ��pH��ͬ����ʵ��١�����̽��pH��P-CP�������ʵ�Ӱ�죬�����Ϊ��̽��pH��P-CP�������ʵ�Ӱ�죻
(3)��Ӧ�¶��ڽϵͷ�Χʱ�������¶����ߣ�������������ǻ����ɻ����������ӣ�ʹP-CP����������ߣ���Ӧ�¶ȹ���ʱ����������ֽ���������������������ǻ����ɻ�������P-CP�������ʼ��٣��ʱ����Ϊ���¶ȸ�H2O2�ֽ�![]() ��
��
(4)��ͼ�����߿��Կ�������pH����10ʱ��P-CP��Ũ�ȼ���û�б仯��˵��pH=10ʱ���ý��ⷴӦ����ֹͣ������Ϊ�ڼ��Խ�ǿ��ʱ��Fe2+��H2O2��Ӧ���ɵ�Fe(OH)3�������ý��ͣ��������ǻ����ɻ������ģ��ʱ����Ϊ��pH=10ʱ�� Fe2+��H2O2��Ӧ���ɵ�Fe(OH)3�������ý��ͣ��������ǻ����ɻ������ģ�����������������Ⱦ�

����Ŀ��Na2S������������Ⱦ�ϡ�����ˮ���е��ؽ����ȡ�
(1)Na2S��Һ��S2-ˮ������ӷ���ʽΪ_________��
(2)����ʱ�������ؽ������ӵ�������ܶȻ��������±���
�������� | FeS | PbS | CuS | HgS |
Ksp | 6.3��10��18 | 1.0��10��28 | 6.3��10��36 | 1.6��10��52 |
�������ʵ���Ũ����ͬ��Fe2+��Pb2+��Cu2+��Hg2+�Ļ��ϡ��Һ�У���μ���Na2Sϡ��Һ�����ȳ�����������____��
����Na2S��Һ������ˮ��Pb2+��ΪʹPb2+������ȫ[c(Pb2��)��1��10-6mol/L]����Ӧ������Һ��c(S2-)��_____mol/L��
�۷�ӦCu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)��ƽ�ⳣ��K=_______��
Fe2+(aq)+CuS(s)��ƽ�ⳣ��K=_______��
(3)�ⶨijNa2S��NaHS�����Ʒ�����ߺ�����ʵ�鲽�����£�
����1.ȷ��ȡһ������Ʒ���ձ��У�������������ˮ�ܽ⣬ת����500mL����ƿ�ж��ݡ�
����2.ȷ��ȡ25.00mL������Һ����ƿ�У��������ػ�GG-��ʱ��������ָʾ������0.2500mol/L�������Һ�ζ���Na2S+HCl=NaHS+NaCl�����յ㣬��������24.00mL���������ټ���5mL���Լ�ȩ(NaHS+HCHO+H2O��NaOH+HSCH2OH)��3�η�ָ̪ʾ����������0.2500mol/L�������Һ�ζ�(NaOH+HCl=NaCl+H2O)���յ㣬����������34.00mL��
����ԭ�������Na2S��NaHS�����ʵ���֮��(д���������)___________��
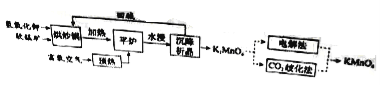
����Ŀ���й��о���Ա���Ƴ�һ�������Ϲ����������̫�����ڴ�������ʵ�ָ�Ч�ֽ�ˮ������Ҫ��������ͼ��ʾ��

��֪�����������л�ѧ���ļ������±���ʾ��
��ѧ�� | H2O��H��O�� | O2��O��O �� | H2��H��H�� | H2O2��O��O�� | H2O2��O��H�� |
����kJ/mol | 463 | 496 | 436 | 138 | 463 |
����Ӧ�����зֽ���2 molˮ��������˵������ȷ����
A. �ܷ�ӦΪ2H2O![]() 2H2��+O2��
2H2��+O2��
B. ����I������926 kJ����
C. ����II�ų���574 kJ����
D. ���̢����ڷ��ȷ�Ӧ