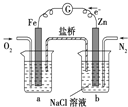
题目内容
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
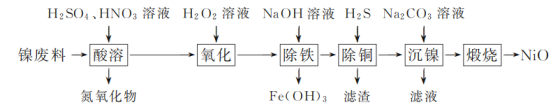
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
【答案】3.3≤pH<7.7 CuS xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
(x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
【解析】
以镍废料(主要成分为镍铁合金,含少量铜)为原料,加入硫酸、硝酸酸浸,Ni转化为NiSO4,同时生成亚铁离子、铁离子、铜离子等,加入过氧化氢,可氧化亚铁离子生成铁离子,加入氢氧化钠调节pH可生成氢氧化铁沉淀,然后通入硫化氢生成CuS沉淀,达到除铜的目的,在滤液中加入碳酸钠溶液可生成xNiCO3yNi(OH)2,煅烧可生成NiO;
(1)根据表格数据分析“除铁”时要求铁离子全部除掉需要的pH;
(2) S2-可与Cu2+反应生成CuS沉淀;
(3)①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,xNiCO3·yNi(OH)2高温下分解生成NiO、CO2和H2O;
②pH越大,溶液碱性越强,结合碱式碳酸镍[用xNiCO3·yNi(OH)2表示]组成分析;
(1) “除铁”时要求铁离子全部除掉,pH![]() 3.3,镍离子和铜离子留在溶液中,pH<7.7,所以需控制溶液的pH范围为3.3≤pH<7.7;
3.3,镍离子和铜离子留在溶液中,pH<7.7,所以需控制溶液的pH范围为3.3≤pH<7.7;
(2)向除铁后的滤液中通入H2S气体,发生反应H2S+Cu2+=CuS↓+2H+,因此滤渣的成分为CuS;
(3)①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,xNiCO3·yNi(OH)2高温下分解生成NiO、CO2和H2O,其化学方程式为:xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O;
(x+y)NiO+xCO2↑+yH2O;
②碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀中Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大,所以碱式碳酸镍中Ni元素含量会增加。

【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
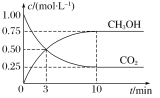
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
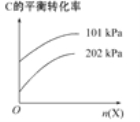
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。