��Ŀ����
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺


��1������ȼ�ϵ�ظ�����Ӧʽ��__________________��
��2��ʯī(C)���ĵ缫��ӦʽΪ________________________��
��3�����ڱ�״���£���2.24 L�����μӷ�Ӧ������װ�������������ɵ��������Ϊ________L ����װ������������ͭ������Ϊ________g��
��4��ijͬѧ���ü���ȼ�ϵ����Ƶ�ⷨ��ȡFe(OH)2��ʵ��װ��(��ͼ��ʾ)��������Fe(OH)2��ʹ�����������������Һ������ѡ��________���缫��
���𰸡�CH4-8e-+10OH-=CO32-+7H2O 2Cl--2e-=Cl2�� 4.48L 12.8 ��
��������
���⣨1������ȼ�ϵ�أ������ڸ�����Ӧ������ʽ��CH4-8e-+10OH-=CO32-+7H2O��
��2����������һ��Ϊ����������һ��Ϊ����������������Ϊ������ʯīΪ��������Ӧ��2Cl--2e-=Cl2��
��3����״���£�2.24 L�������ʵ���=0.1mol��ת�Ƶ���0.4mol��������Ӧ��2H++2e-=H2��������0.2mol���������=0.2��22.4=4.48L����ת�Ƶ�����ȣ�����������Ӧ��Cu2++2e-=Cu������ͭ���ʵ�����0.2mol������=0.2��56=12.8g��
��4��Ϊ���ɶ��������������������缫��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�����Ŀ����������(��Ҫ�ɷ�Ϊ�����Ͻ𣬺�����ͭ)Ϊԭ�ϣ�����NiO�IJ��ֹ����������£�
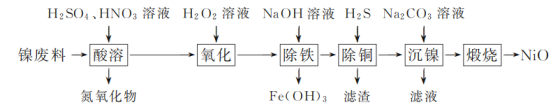
��֪���±��г��˼��ֽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0 mol��L��1����)��
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.3 | 9.9 | 9.2 |
��1����������ʱ�������Һ��pH��ΧΪ________��
��2��������������Ҫ�ɷ�Ϊ________(�ѧʽ)��
��3����������ʱ�õ���ʽ̼����[��xNiCO3��yNi(OH)2��ʾ]������
���ڸ������������£�����������ʽ̼�����õ�NiO���÷�Ӧ�Ļ�ѧ����ʽΪ________��
����������ʱ����ҺpH����ʽ̼������NiԪ�غ��������ӣ�ԭ����________��



