题目内容
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
【答案】B
【解析】
A.在25℃、101 kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,产物水的状态不是液态,A错误;
B.由于该反应正反应为吸热反应,温度越低越有利于反应逆向进行,所以锡制品在寒冷的冬天因易转化为灰锡而损坏,B正确;
C.该热化学方程式表示“在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时放出57.3kJ的热量”,氨水为弱碱溶液,电离需要吸热,所以将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则放出能量小于57.3kJ,C错误;
D.根据盖斯定律:
C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1 ①
C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 ②
①-②得C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1,根据能量越低越稳定原理,石墨比金刚石稳定,D错误;
正确答案:B。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]________,下列状态的铝中,电离最外层的一个电子所需能量最小的是_____________(填标号)。
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8—羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______; 所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是____________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_______;其中Al的配位数为_________。
(4)GaAs的晶胞结构如图所示,紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() =________。
=________。

【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
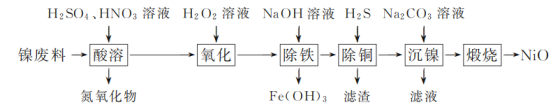
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。