题目内容
【题目】已知可逆反应M(g)+N(g) ![]() P (g)+Q(g) ,请回答下列问题:
P (g)+Q(g) ,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 molL-1,c(N)=2.4 molL-1,达到平衡后,M的转化率为60%,此时N的转化率为__________ ;该温度时K=_________。
(2)若温度升高K值增大,则该反应为______反应。(填“吸热”或“放热”)。理由_________________。
(3)若反应温度升高,M的转化率______(填“增大”“减小”或“不变”;)
(4)若反应温度不变,反应物的起始浓度分别为:c(M)= 4molL-1, c(N)=a molL-1;达到平衡后,c(P)=2 molL-1,a=________。
(5)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b molL-1,达到平衡后,M的转化率为________。
【答案】25% 0.5 吸热 温度升高K值增大是吸热反应 增大 6 41%
【解析】
平衡常数的相关计算,可以列三段式进行计算。
(1)列三段式: ,N的转化率为:
,N的转化率为:![]() ,
,![]() ,
,
故答案为:25%;0.5;
(2)温度升高K值增大,K增大说明平衡向右移动,升温向右移动,所以正反应为吸热反应,
故答案为:吸热;温度升高K值增大是吸热反应;
(3)正反应为吸热反应,升高温度平衡向右移动,所以M的转化率增大,
故答案为:增大;
(4)列三段式: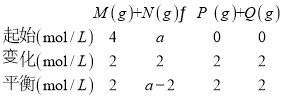 ,根据平衡常数
,根据平衡常数![]() ,解得a=6,
,解得a=6,
故答案为:6;
(5)设达到平衡时M的浓度减小x mol/L, 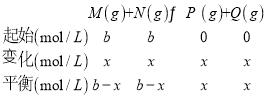 ,根据平衡常数
,根据平衡常数![]() ,解得
,解得![]() ,故M的转化率为
,故M的转化率为![]() ,
,
故答案为:41%

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
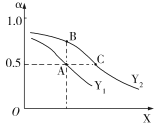
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]________,下列状态的铝中,电离最外层的一个电子所需能量最小的是_____________(填标号)。
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8—羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______; 所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是____________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_______;其中Al的配位数为_________。
(4)GaAs的晶胞结构如图所示,紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() =________。
=________。

【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
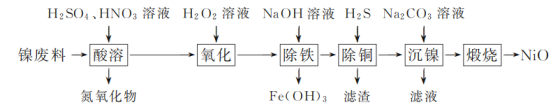
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。



