��Ŀ����
����Ŀ����1�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣��֪��
C(s��ʯī)��O2(g)===CO2(g) ��H1����393.5 kJ��mol��1
2H2(g)��O2(g)===2H2O(l) ��H2����571.6 kJ��mol��1
2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l) ��H3����2599 kJ��mol��1
���ݸ�˹���ɣ�д��298 Kʱ��C(s��ʯī)��H2(g)����1 mol C2H2(g)�Ȼ�ѧ����ʽ��__________________________________________��
��2����1.0 L����ܱ������г���4.0 mol A(g)��4.0 mol B(g)����һ���¶��½��з�Ӧ��A(g)+B(g)C(g) ��H����ò�ͬʱ�̸����������ʵ����ʵ������±�:
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
�ش��������⣺
�������¶ȵ����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ����С������H___(����>����<������=��)0����Ӧ����ʼ��30min��A��ƽ����Ӧ������_______�����¶��£�������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ____��
������ѡ������˵���÷�Ӧ��һ���¶Ⱥͺ��������´ﵽƽ��״̬����________��
A. ��Ӧ���ʣ�vA(��) =vC(��) B. A��������C���������
C. B��ת���ʲ��ٸı� D. �ܶȲ��ٸı�
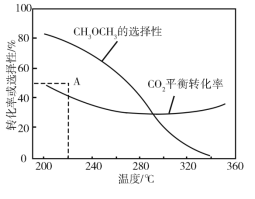
��3������ӦC(g)A(g)+B(g)����ʱ�����ϡ�ͼ�X����(�����뷴Ӧ)����C��ƽ��ת������ѹǿ��X�����ʵ����Ĺ�ϵ��ͼ��ʾ��
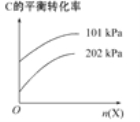
��������������ʱ������X�����ʵ�����C��ƽ��ת���ʽ�________(��������������С������������)����ԭ����______________________________��
���𰸡�2C(s ʯī)+H2(g)= C2H2(g) ��H=+226.7kJmol-1 �� 0.1mol/(Lmin) 3 AC ���� ����X�����ʵ���������������������൱�ڼ�С��Ӧ��ϵ��ѹǿ��ƽ�����ƣ�C��ƽ��ת��������
��������
��1�����ø�˹���ɼ��㷴Ӧ�ȣ�����д�Ȼ�ѧ����ʽ��
��2���������¶����ߣ���ѧƽ�ⳣ����С��˵����ѧƽ�������ƶ���������ӦΪ���ȷ�Ӧ�����ݱ���������֪����30minʱ��Ӧ����ƽ��״̬��n(C)=3mol�����ݻ�ѧ����ʽ���㣬��ʱn(A)=n(B)=1mol����n(A)=3mol������![]() ���㷴Ӧ����ʼ��30min��A��ƽ����Ӧ���ʣ��ټ���ƽ��ʱc(C)��c(A��c(B)������������¶��·�Ӧ��ƽ�ⳣ����
���㷴Ӧ����ʼ��30min��A��ƽ����Ӧ���ʣ��ټ���ƽ��ʱc(C)��c(A��c(B)������������¶��·�Ӧ��ƽ�ⳣ����
�ڸ÷�ӦA(g)+B(g)C(g)ǰ���������ʵ����仯�����¶�һ���������ݻ����ݣ���ѧƽ��״̬ʱ���淴Ӧ������ȣ������ʵ�����Ũ�ȵȱ��ֲ��䣬�Լ�����������һЩ��Ҳ���䣬��һ���������仯�����������ˣ��ݴ˷����жϣ�
��3����ͼ��֪������X�����ʵ���������C��ƽ��ת����������ԭ��������X�����ʵ���������������������൱�ڼ�С��Ӧ��ϵ��ѹǿ���ݴ˷����жϡ�
��1������֪�Ȼ�ѧ����ʽ��ţ���C(s��ʯī)��O2(g)===CO2(g) ��H1����393.5 kJ��mol��1����2H2(g)��O2(g)===2H2O(l) ��H2����571.6 kJ��mol��1����2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l) ��H3����2599 kJ��mol��1�����ø�˹���ɽ�����2+����![]() -����
-����![]() �ɵã�2C(s ʯī)+H2(g)= C2H2(g) ����H=��-393.5kJ/mol����2+
�ɵã�2C(s ʯī)+H2(g)= C2H2(g) ����H=��-393.5kJ/mol����2+![]() ����-571.6kJ/mol��-
����-571.6kJ/mol��-![]() ����-2599 kJ/mol��= +226.7kJmol-1������C(s��ʯī)��H2(g)����1 mol C2H2(g)���Ȼ�ѧ����ʽΪ��2C(s ʯī)+H2(g)= C2H2(g) ��H=+226.7kJmol-1��
����-2599 kJ/mol��= +226.7kJmol-1������C(s��ʯī)��H2(g)����1 mol C2H2(g)���Ȼ�ѧ����ʽΪ��2C(s ʯī)+H2(g)= C2H2(g) ��H=+226.7kJmol-1��
�ʴ�Ϊ��2C(s ʯī)+H2(g)= C2H2(g) ��H=+226.7kJmol-1��
��2���������¶����ߣ���ѧƽ�ⳣ����С��˵����ѧƽ�������ƶ���������ӦΪ���ȷ�Ӧ������H��0�����ݱ���������֪����30minʱ��Ӧ����ƽ��״̬��n(C)=3mol�����ݻ�ѧ����ʽ���㣬ƽ��ʱ����n(A)=3mol����Ӧ����ʼ��30min��A��ƽ����Ӧ������![]() ����30minʱ��Ӧ����ƽ��״̬����ʱn(A)=n(B)=1mol����ƽ��ʱc(C)=3mol/L��c(A)=c(B)=1mol/L������¶��·�Ӧ��ƽ�ⳣ��Ϊ
����30minʱ��Ӧ����ƽ��״̬����ʱn(A)=n(B)=1mol����ƽ��ʱc(C)=3mol/L��c(A)=c(B)=1mol/L������¶��·�Ӧ��ƽ�ⳣ��Ϊ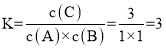 ��
��
�ʴ�Ϊ��<��0.1mol/(Lmin)��3��
�ڸ÷�ӦA(g)+B(g)C(g)ǰ���������ʵ����仯�����¶�һ���������ݻ����ݣ�
A. ��Ӧ���ʣ�vA(��) =vC(��)�������淴Ӧ������ȣ���˵���÷�Ӧ�ﵽƽ��״̬��A����ȷ��
B. A��������C��������ȣ�����˵�����淴Ӧ������ȣ�����˵���÷�Ӧ�ﵽƽ��״̬��B�����
C. B��ת���ʲ��ٸı䣬˵��B�����ʵ������ֲ��䣬���淴Ӧ���ʲ��䣬��˵���÷�Ӧ�ﵽƽ��״̬��C����ȷ��
D. ���������غ㶨��֪�����������������䣬�����ݻ����䣬���ܶ�ʼ�ձ��ֲ��䣬���ܶȲ��ٸı䣬����˵���÷�Ӧ�ﵽƽ��״̬��D�����
�ʴ�Ϊ��AC��
��3����ͼ��֪������X�����ʵ���������C��ƽ��ת����������ԭ��������X�����ʵ���������������������൱�ڼ�С��Ӧ��ϵ��ѹǿ��ƽ�����ƣ�C��ƽ��ת��������
�ʴ�Ϊ����������X�����ʵ���������������������൱�ڼ�С��Ӧ��ϵ��ѹǿ��ƽ�����ƣ�C��ƽ��ת��������

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�����Ŀ����������(��Ҫ�ɷ�Ϊ�����Ͻ𣬺�����ͭ)Ϊԭ�ϣ�����NiO�IJ��ֹ����������£�
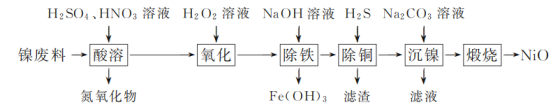
��֪���±��г��˼��ֽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0 mol��L��1����)��
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.3 | 9.9 | 9.2 |
��1����������ʱ�������Һ��pH��ΧΪ________��
��2��������������Ҫ�ɷ�Ϊ________(�ѧʽ)��
��3����������ʱ�õ���ʽ̼����[��xNiCO3��yNi(OH)2��ʾ]������
���ڸ������������£�����������ʽ̼�����õ�NiO���÷�Ӧ�Ļ�ѧ����ʽΪ________��
����������ʱ����ҺpH����ʽ̼������NiԪ�غ��������ӣ�ԭ����________��