题目内容
9.下面是一些原子的2p轨道和3d轨道中电子排布的情况,其中正确的是( )| A. |  | B. | 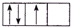 | C. | 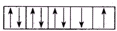 | D. | 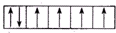 |
分析 原子核外电子排布,应满足能量最低原理,洪特规则以及泡利不相容原理,以此进行判断.
解答 解:A.同一轨道自旋方向相同,违反泡利不相容原理,故A错误;
B.2p能层有3个电子,应在3个不同的轨道,不符合洪特规则,故B错误;
C.不同轨道的单电子自旋方向相同,违反了洪特规则,故C错误;
D.符合洪特规则、泡利不相容原理,故D正确.
故选D.
点评 本题考查原子核外电子排布,题目难度不大,本题注意把握核外电子的排布规律即可解答该题.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
20.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
4.寻找新能源是解决温室效应的一条重要思路.磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li ?放电充电 LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
14.下列实验现象中,由于发生取代反应而引起的是( )
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 苯滴加到溴水中,振荡后水层接近无色 | |
| C. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 | |
| D. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
1.某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
18.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
19.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 全部由非金属元素形成的化合物不一定只含共价键 | |
| C. | 离子化合物中不可能含有非极性键 | |
| D. | 非极性键只存在于双原子单质分子中 |