题目内容
18.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
分析 A、CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中阴阳离子个数比都是1:1,再根据N=nNA计算;
B、一个C2H5OH分子中含有5个C-H键,再根据N=n NA计算;
C、S2和S8均由S原子构成;
D、根据过氧化钠与水的反应为歧化反应来分析.
解答 解:A、CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中阴阳离子个数比都是1:1,与各物质的物质的量的多少无关,所以1molCaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为2NA,故A错误;
B、一个C2H5OH分子中含有5个C-H键,所以0.1molC2H5OH中所含C-H键的数目为0.5 NA,故B错误;
C、由于S2和S8均由S原子构成,故6.4g混合物中无论两者的比例如何,含有的氧原子的物质的量均为n=$\frac{6.4g}{32g/mol}$=0.2mol,个数为0.2NA个,故C正确;
D、78g过氧化钠的物质的量为1mol,而过氧化钠与水的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑ 1mol过氧化钠转移电子1mol电子,即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是C,明确分子的构成是解本题的关键.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
8.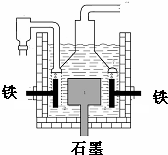 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
6. 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
请回答下列问题:
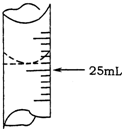
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1044mol•L-1(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
13.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
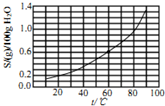

| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
3.指定条件下,下列说法中正确的是( )
| A. | 常温下,28g C2H4中含有的极性共价键数为6NA | |
| B. | 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 浓度均为0.1 mol•L-1的C6H5ONa溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 | |
| D. | 常温下,浓度分别为0.1 mol•L-1和0.01 mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍 |
2.盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.则原混合气体中O2和NO2的体积比是( )
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |

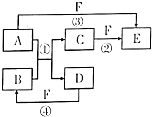 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)