题目内容
5.现有以下物质①KNO3溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤AgCl固体⑥蔗糖⑦酒精⑧熔融的NaCl⑨氨水⑩盐酸,其中能够导电的是①④⑧⑨⑩(填序号,下同);属于电解质的是③⑤⑧;属于非电解质的是②⑥⑦.分析 电解质在水溶液或熔化状态下能够导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是指在水溶液里和熔化状态下都不能导电的化合物,包括非金属氧化物、氨气、大部分有机物;
单质和混合物既不是电解质,也不是非电解质.
解答 解:①NaCl溶液是混合物,既不是电解质,也不是非电解质,NaCl溶液是电解质氯化钠的水溶液,它能够导电;
②干冰(固态的二氧化碳)是非金属氧化物,属于非电解质;
③冰醋酸(纯净的醋酸)是酸,属于电解质;
④铜是单质,既不是电解质,也不是非电解质,铜能导电;
⑤AgCl固体是盐,属于电解质;
⑥蔗糖在水溶液里和熔化状态下都不能导电,属于非电解质;
⑦酒精在水溶液里和熔化状态下都不能导电,属于非电解质;
⑧熔融的KNO3是盐,属于电解质,存在自由的钾离子和硝酸根离子,能够导电;
⑨氨水是氨气的水溶液,是混合物,能导电;
⑩盐酸是氯化氢的水溶液能导电,是混合物;
所以能够导电的是①④⑧⑨⑩;属于电解质的是③⑤⑧;属于非电解质的是②⑥⑦.
故答案为:①④⑧⑨⑩;③⑤⑧;②⑥⑦.
点评 本题考查电解质和非电解质,明确概念的要点即可解答,抓住化合物来分析是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某工厂排放的废水(含NH4Cl)中,氮元素的质量分数为0.55%,则该废水中NH4Cl的质量分数约是( )
| A. | 2.1% | B. | 2.6% | C. | 0.46% | D. | 0.55% |
13.已知硫、二氧化硫、三氧化硫三种物质的质量比为2:4:5,它们的物质的量之比为( )
| A. | 2:4:5 | B. | 1:1:1 | C. | 5:4:2 | D. | 1:2:3 |
20.两种气态烃的混和物共0.3mol,完全燃烧后得11.76L(标况下)CO2和13.5g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混和物 |
10.工业制硫酸的一步重要反应是SO2在400~500℃下的催化剂氧化:2SO2+O2?2SO3,这是一个正反应放热的反应,如果反应在密闭容器中进行.下述一个说法中错误的是( )
| A. | 实际生产中鼓入过量的空气,是为了提高SO2的转化率 | |
| B. | 即使在实际生产中鼓入过量的空气,但此过程产生的炉气中仍含有少量SO2 | |
| C. | 此反应中反应物的总能量高于生成物的总能量 | |
| D. | 使用催化剂是为了改变该化学反应的限度 |
14.下列化学反应的离子方程式正确的是( )
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
15.X元素的阳离子和Y元素的阴离子的核外电子层结构相同,下列叙述正确的是( )
| A. | 离子半径X>Y | B. | 原子半径X<Y | ||
| C. | 原子序数X<Y | D. | 原子最外层电子数X<Y |
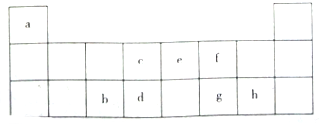 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: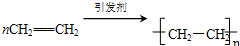 ;
;