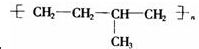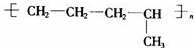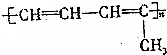题目内容
5.某工厂排放的废水(含NH4Cl)中,氮元素的质量分数为0.55%,则该废水中NH4Cl的质量分数约是( )| A. | 2.1% | B. | 2.6% | C. | 0.46% | D. | 0.55% |
分析 废水中N元素质量分数=NH4Cl的质量分数×NH4Cl中N元素的质量分数.
解答 解:由于废水中N元素质量分数=NH4Cl的质量分数×NH4Cl中N元素的质量分数,废水(含NH4Cl)中氮元素的质量分数为0.55%,则该废水中NH4Cl的质量分数约是$\frac{0.55%}{\frac{14}{53.5}}$=2.1%,故选A.
点评 本题考查质量分数有关计算,比较基础,注意对质量分数的理解与灵活应用.

练习册系列答案
相关题目
16.寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量.以下分析错误的是( )
| A. | 该过程是将化学能转化为热能 | |
| B. | 其发热原理与钢铁的电化学腐蚀相同 | |
| C. | 活性炭作正极,电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 铁作负极,电极反应为:Fe-3e-═Fe3+ |
20.关于乙烯与乙烷的结构与性质的描述中,不正确的是( )
| A. | 乙烯分子为平面结构,乙烷分子为空间立体结构 | |
| B. | 乙烯、乙烷分子中都含有极性键和非极性键 | |
| C. | 乙烯能发生加成反应,而乙烷不能 | |
| D. | 乙烯分子里的C═C双键键能是乙烷分子里C-C单键键能的两倍 |
10.只含铁和氧两种元素的样品A在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,过滤,得到沉淀的质量是原样品A质量的$\frac{50}{29}$,则下列说法正确的是( )
| A. | A一定是Fe3O4 | B. | A可能是Fe3O4 | C. | A一定是纯净物 |
4.能证明乙烯分子里含有一个碳碳双键的事实是( )
| A. | 乙烯分子里碳氢原子的个数比为1:2 | |
| B. | 乙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 乙烯容易与溴水发生加成反应,且1 mol乙烯完全加成消耗1 mol溴单质 | |
| D. | 乙烯能使酸性KMnO4溶液褪色 |
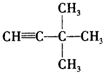 :3,3-二甲基-1-丁炔;
:3,3-二甲基-1-丁炔;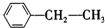 :乙苯.
:乙苯.