题目内容
15.X元素的阳离子和Y元素的阴离子的核外电子层结构相同,下列叙述正确的是( )| A. | 离子半径X>Y | B. | 原子半径X<Y | ||
| C. | 原子序数X<Y | D. | 原子最外层电子数X<Y |
分析 X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则X元素处于Y元素的下一周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,电子层结构相同的离子,核电荷数越大离子半径越小,以此来解答.
解答 解:X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,则X元素处于Y元素的下一周期,X为金属元素,Y为非金属元素.
A.X位于Y的下一周期,X核电荷数较大,X、Y离子的电子层结构相同,核电荷数越大离子半径越小,则离子半径X<Y,故A错误;
B.X在Y的下一周期,且X最外层电子数较小,则原子半径为X>Y,故B错误;
C.X在Y的下一周期,则原子序数X>Y,故C错误;
D.X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,故D正确;
故选D.
点评 本题考查原子结构与元素性质,明确元素的位置是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下图中,能形成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
10.下列说法正确的是( )
| A. | 按系统命名法,化合物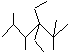 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 酯类物质是形成水果香味的主要成分 |
20.某原电池总反应式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C、负极为Fe,电解质溶液为H2SO4溶液 | |
| C. | 正极为Ag、负极为Fe,电解质溶液为FeSO4溶液 | |
| D. | 正极为Ag、负极为Fe,电解质溶液为Fe2(SO4)3溶液 |
7.在密闭容器中充入4mol X,在一定温度下4X(g)?3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是( )
| A. | 3.4 mol | B. | 4 mol | C. | 2.8 mol | D. | 1.2 mol |
4.下列实验方法或数据合理的是( )
| A. | 用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液 | |
| B. | 用托盘天平准确称取9.8g NaCl 固体 | |
| C. | 用广泛pH试纸测出某盐酸溶液的pH为3.2 | |
| D. | 用10mL量筒量取7.50mL稀盐酸 |
5.下列说法正确的是( )
| A. | 摩尔是七个基本物理量之一 | B. | 阿伏伽德罗常数是没有单位的 | ||
| C. | 氮气的摩尔质量是28g | D. | 1molH2O约含有6.02×1023个水分子 |