题目内容
20.两种气态烃的混和物共0.3mol,完全燃烧后得11.76L(标况下)CO2和13.5g水,下列说法正确的是( )| A. | 一定有乙烯 | B. | 可能有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混和物 |
分析 n(CO2)=$\frac{11.76L}{22.4L/mol}$=0.525mol,n(H2O)=$\frac{13.5g}{18g/mol}$=0.75mol,则平均C原子数目为$\frac{0.525mol}{0.3mol}$=1.75,平衡H原子数目为$\frac{0.75mol×2}{0.3mol}$=5,则混合的平均化学式为C1.75H5,因是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,则另一种烃分子中碳原子大于1且H原子数大于5,一定没有乙烯,根据平均碳原子数目计算甲烷与乙烷物质的量之比,再计算平均H原子数目是否为5,判断另外一种是否可以为乙烷.
解答 解:n(CO2)=$\frac{11.76L}{22.4L/mol}$=0.525mol,n(H2O)=$\frac{13.5g}{18g/mol}$=0.75mol,则平均C原子数目为$\frac{0.525mol}{0.3mol}$=1.75,平衡H原子数目为$\frac{0.75mol×2}{0.3mol}$=5,则混合的平均化学式为C1.75H5,因是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,则另一种烃分子中碳原子大于1且H原子数大于5,一定没有乙烯,若为乙烯,根据平均碳原子数目可知,由十字相乘法可知甲烷与乙烷物质的量之比为(2-1.75):(1.75-1)=1:3,则平均H原子数目为$\frac{1×4+6×3}{1+3}$=5.5≠5,故也不可能为乙烷,故ACD错误,B正确,故选B.
点评 本题考查分子式的确定、混合物计算,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

| A. | 乙烯分子为平面结构,乙烷分子为空间立体结构 | |
| B. | 乙烯、乙烷分子中都含有极性键和非极性键 | |
| C. | 乙烯能发生加成反应,而乙烷不能 | |
| D. | 乙烯分子里的C═C双键键能是乙烷分子里C-C单键键能的两倍 |
| A. | CO与CO2互为同素异形体 | B. | 金刚石与石墨互为同分异构体 | ||
| C. | 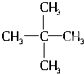 与 与 是同分异构体 | D. | 冰与水互为同分异构体 |
| A. | 胶体粒子的大小通常在0.1~1nm之间 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 可以通过过滤分离溶液和胶体 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |
| A. | 18g水中含有的原子数为2NA | |
| B. | 11.2L O2一定含有NA个原子 | |
| C. | 标准状况下,NA个水分子所占体积为22.4L | |
| D. | NA个氧分子和NA个氢分子的质量比等于16:1 |
| A. | $\frac{4M}{{a}^{3}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
| A. | 按系统命名法,化合物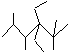 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 酯类物质是形成水果香味的主要成分 |