题目内容
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。
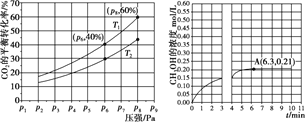
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
【答案】 < -90.77 kJ·mol-1 < 反应Ⅲ为放热反应,温度降低,反应正向移动,所以 T1<T2 4/27 或 0.148 降低压强 0.08 mol·L-1min-1 8/15 或 0.533
【解析】
(1)气体物质的混乱度与分子数有关,分子数越大混乱度越大,反应III正反应气体分数目减小,所以混乱度减小,熵减小ΔS<0。根据盖斯定律,因为反应II=反应III反应I,所以ΔH2=-49.58kJ/mol-41.19kJ/mol=-90.77kJ/mol。
(2) 从CO2 的平衡转化率与压强的关系曲线图上看出,当压强相同时T1曲线的转化率大于T2曲线的转化率,说明T2→T1过程平衡向正反应方向移动,而反应III正反应是放热反应,根据勒夏特列原理,降低温度平衡向放热方向移动,所以T1<T2,答案:< 反应Ⅲ为放热反应,温度降低,反应正向移动,所以 T1<T2。
②由CO2 的平衡转化率与压强的关系曲线图知,T1和P6的条件下CO2的平衡转化率为40%,
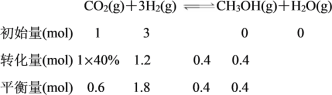
此温度下平衡常数为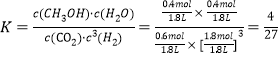 ;
;
a.由图像可知,改变条件达到平衡所用的时间大于5min,说明反应速率减慢,而且平衡时(A点)CH3OH浓度比原平衡(![]() )小,所以改变的条件只能是降低压强;由图像知第4min到A点甲醇浓度变化量Δc(CH3OH)=0.21mol/L-0.15mol/L=0.06mol/L,所以H2的变化浓度Δc(H2)=3Δc(CH3OH)=3×0.06mol/L=0.18mol/L,所以用H2表示的反应速率
)小,所以改变的条件只能是降低压强;由图像知第4min到A点甲醇浓度变化量Δc(CH3OH)=0.21mol/L-0.15mol/L=0.06mol/L,所以H2的变化浓度Δc(H2)=3Δc(CH3OH)=3×0.06mol/L=0.18mol/L,所以用H2表示的反应速率![]() ;
;
b.由图可知,T1和P8条件下CO2的转化率为60%,设此时容器容积为VL,因为温度不变平衡常数不变,K=![]() 。
。
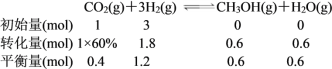
将数值代入平衡常数计算式中: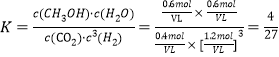 ,解得V=
,解得V=![]() 或0.533。
或0.533。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案