题目内容
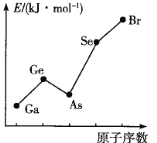
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________
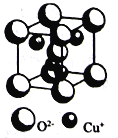
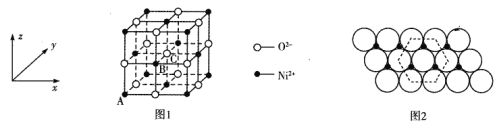
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
【答案】3d104s2 1 正四面体 配位键和极性共价键 sp3 大 NH3分子和H2O分子均为极性分子,且NH3分子和H2O分子之间能形成氢键 铜失去的是全充满的3d10电子,而锌失去的是半充满的4s1电子,4s能级的能量低于3d能级的能量 4 ![]()
【解析】
(1)基态锌原子的核外电子排布式为:[Ar]3d104s2,故其价电子排布式为3d104s2;基态铜元素的核外电子排布式为:[Ar]3d104s1,其4s能级轨道中有1个未成对电子;
(2)①[Zn(NH3)4]SO4中,阴离子为SO42-,中心原子S的孤电子对数=![]() (6+2-4×2)=0,SO42-离子的价层电子对数为4,故其空间立体构型为正四面体;[Zn(NH3)4]2+为配位离子,N与H之间的化学键是极性共价键,N与Zn2+之间是配位键,故[Zn(NH3)4]2+中含有的化学键有极性共价键和配位键;
(6+2-4×2)=0,SO42-离子的价层电子对数为4,故其空间立体构型为正四面体;[Zn(NH3)4]2+为配位离子,N与H之间的化学键是极性共价键,N与Zn2+之间是配位键,故[Zn(NH3)4]2+中含有的化学键有极性共价键和配位键;
②NH3分子中成键电子对数为3,孤电子对数为1,故中心原子的轨道杂化类型为sp3;NH3在水中的溶解度极大(1:700);其原因是:NH3分子和H2O分子均为极性分子,且NH3分子和H2O分子之间能形成氢键;
(3)Cu的第二电离能大于Zn的第二电离能的原因是:铜失去的是全充满的3d10电子,而锌失去的是半充满的4s1电子,4s能级的能量低于3d能级的能量,因此Cu的第二电离能大于Zn的第二电离能;
(4)由晶胞图可知,O2-位于四个Cu+形成的正四面体的体心内,故O2-的配位数为4。由均摊法可知,一个晶胞中含有8×1/8+1=2个O2-和4个Cu+,即一个晶胞中含有两个Cu2O,一个晶胞的质量为![]() ,由此可知晶胞参数a=
,由此可知晶胞参数a= cm=
cm=![]() 。
。

【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42— |
B | 先滴加足量稀硝酸,再滴入AgNO3溶液 | 开始无明显现象,后产生白色沉淀 | 原溶液中有Cl- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A. AB. BC. CD. D