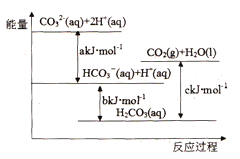
题目内容
【题目】已知分解1molKClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是
A. 1molKClO3所具有的总能量高于1molKCl所具有的总能量
B. 1gKClO3 ,1gMnO2,0.1gMn2O7混合加热,充分反应后MnO2质量仍为1g
C. KClO3分解速率快慢主要取决于反应①
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
【答案】B
【解析】
A.分解1molKClO3放出热量38.8kJ ,可以知道分解反应为放热反应;
B. 慢反应为决定反应速率的主要因素;
C.由反应②可以知道, Mn2O7分解会生成一部分MnO2;
D.催化剂的接触面积增大,可加快反应速率。
A.反应2KClO3=2KCl+3O2为放热反应,故1mol KClO3所具有的总能量高于1molKCl和1.5mol O2所具有的总能量之和,故A正确;
B.由反应②可以知道,0.1gMn2O7分解会生成一部分MnO2,,故反应后MnO2的总质量大于1g,故B错误;
C. 由分解机理可以知道, KClO3的分解速率取决于慢反应,即反应①,故C正确;
D.由分解机理可以知道, KClO3的分解速率取决于慢反应,即反应①,将固体二氧化锰碾碎,可加快反应①的反应速率,故D正确;
综上所述,本题选B。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42— |
B | 先滴加足量稀硝酸,再滴入AgNO3溶液 | 开始无明显现象,后产生白色沉淀 | 原溶液中有Cl- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A. AB. BC. CD. D
【题目】乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性KMnO4溶液和2 mL 0.1 mol·L-1 H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA________tB(填“>”“=”或“<”)。已知该反应的离子方程式:2MnO![]() +5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
+5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.100 0 mol·L-1 KMnO4标准溶液装入______(填“酸式”或“碱式”)滴定管,进行滴定操作。
在滴定过程中发现,刚滴下少量KMnO4标准溶液时,溶液紫红色并没有马上褪去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪去,可能的原因是__________________________________________;判断滴定达到终点的现象是________________________________________________________________________。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________。
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
④误差下列操作会导致测定结果偏高的是________。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
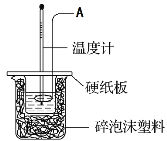
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。