题目内容
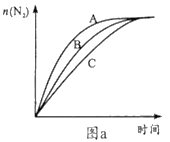
【题目】室温下,向0.01 mol/L的醋酸溶液中,滴入1.00 mol/L、pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化如图所示。下列分析正确的是

A. a点,pH=2
B. b点,c(CH3COO-)>c(NH![]() )
)
C. c点,pH可能大于7
D. ab段,醋酸溶液的稀释是溶液pH增大的主要原因
【答案】B
【解析】A.醋酸是弱酸,0.01 mol/L的醋酸溶液的pH > 2,选项A错误;B.b点为醋酸和醋酸铵的混合溶液,溶液显酸性,pH逐渐接近7,根据电荷守恒,c(CH3COO-) + c(OH-)= c(NH4+)+ c(H+),因此c(CH3COO-) > c(NH4+),选项B正确;C.酸性溶液和中性溶液混合,不可能变成碱性,选项C错误;D.ab段,滴入醋酸铵溶液,开始时为醋酸根离子结合氢离子产生醋酸H+ + CH3COO-![]() CH3COOH,使c(H+)减小,溶液pH增大,选项D错误;答案选B。
CH3COOH,使c(H+)减小,溶液pH增大,选项D错误;答案选B。

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
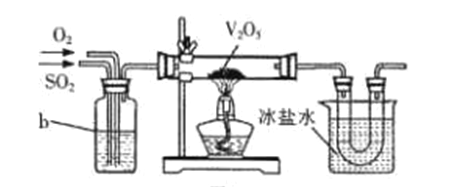
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
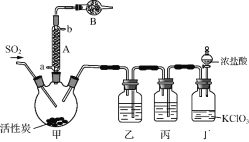
(1) 仪器A冷却水的进口_______(填“a”或“b”)。
(2) 仪器B中盛放的药品是_______。
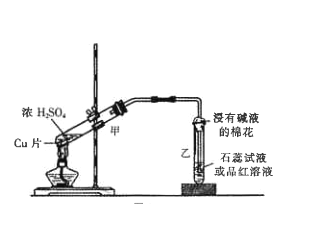
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______,以下与二氧化硫有关的说法中正确的是_______。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____。