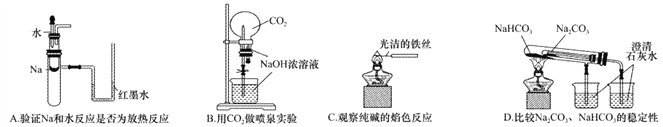
题目内容
【题目】(题文)已知:pOH=-lgc(OH-)。常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。下列说法正确的是

A. 溶液加水稀释,![]() 先增大后不变
先增大后不变
B. 在NaHXO3溶液中:![]() >1
>1
C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)
D. 实线M表示pOH与![]() 的变化关系
的变化关系
【答案】B
【解析】
A. 溶液加水稀释,c(H+)×c(XO32-)/c(HXO3-)的值不变;B. 在NaHXO3溶液中,![]() = [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=Kh/Ka1,结合pOH=2计算;C.根据溶液中电荷守恒及中性溶液中c(H+)=c(OH-)进行分析;D.已知 pOH=-lgc(OH-),则pOH越大,c(OH-)越小,当pOH较大时,溶液中的氢离子较多,则c(H2XO3)较大,所以实线M表示pOH与
= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=Kh/Ka1,结合pOH=2计算;C.根据溶液中电荷守恒及中性溶液中c(H+)=c(OH-)进行分析;D.已知 pOH=-lgc(OH-),则pOH越大,c(OH-)越小,当pOH较大时,溶液中的氢离子较多,则c(H2XO3)较大,所以实线M表示pOH与![]() 的变化关系;根据以上分析解答。
的变化关系;根据以上分析解答。
Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,Kw不变,因此c(H+)增大,Na2XO3溶液加水稀释,![]() 一直增大,A错误;
一直增大,A错误;![]() = [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=Kh/Ka1,根据图像当
= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=Kh/Ka1,根据图像当![]() =0时,溶液的pOH=4,水解大于电离,溶液显碱性,所以Kh/Ka1>1,即在NaHXO3溶液中:
=0时,溶液的pOH=4,水解大于电离,溶液显碱性,所以Kh/Ka1>1,即在NaHXO3溶液中:![]() >1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3为强碱弱酸盐,水解显碱性,分两步水解:XO32-+H2O= HXO3-+ OH-, HXO3-+ H2O= H2XO3+ OH-;水解的第一步程度较大,因此c(HXO3-)/c(XO32-)比值较大,当c(HXO3-)/c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(HXO3-)/c(XO32-)=10-9时,溶液的碱性最强,pOH=0;所以实线M表示pOH与
>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3为强碱弱酸盐,水解显碱性,分两步水解:XO32-+H2O= HXO3-+ OH-, HXO3-+ H2O= H2XO3+ OH-;水解的第一步程度较大,因此c(HXO3-)/c(XO32-)比值较大,当c(HXO3-)/c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(HXO3-)/c(XO32-)=10-9时,溶液的碱性最强,pOH=0;所以实线M表示pOH与![]() 的变化关系,D错误;正确选项B。
的变化关系,D错误;正确选项B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案