题目内容
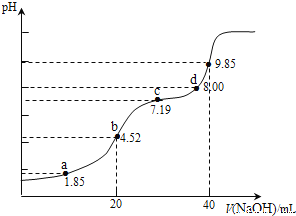
【题目】25℃时,下图烧杯中各盛有40 mL的溶液。

(1)甲溶液pH=__________,水电离的c(OH-)=________mol/L。
(2)若分别取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水电离的c(H+)=________mol/L;溶液中离子浓度大小顺序是__________。
(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,该溶液中离子浓度大小顺序是___________。
【答案】 1 ![]()
![]() c(Cl-)>c(NH
c(Cl-)>c(NH![]() )>c(H+)>c(OH-) c(NH
)>c(H+)>c(OH-) c(NH![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
【解析】(1)0.100mol/L盐酸中c(H+)= c(HCl)=0.100mol/L,pH=1,c(OH-)= 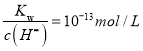 ,氢氧根离子全部由水电离产生,则水电离的c(OH-)=
,氢氧根离子全部由水电离产生,则水电离的c(OH-)=![]() ;(2)等浓度的盐酸和氨水等体积混合完全反应,得到氯化铵溶液,氯化铵水解促进水的电离,溶液呈酸性,水电离的c(H+)= c(OH-)=
;(2)等浓度的盐酸和氨水等体积混合完全反应,得到氯化铵溶液,氯化铵水解促进水的电离,溶液呈酸性,水电离的c(H+)= c(OH-)=![]() mol/L;铵根离子水解,则c(Cl-)>c(
mol/L;铵根离子水解,则c(Cl-)>c(![]() ),故溶液中离子浓度大小顺序是c(Cl-)>c(
),故溶液中离子浓度大小顺序是c(Cl-)>c(![]() )>c(H+)>c(OH-);(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液为一水合氨和氯化铵比1:1形成的溶液,pH>7说明一水合氨的电离大于铵根离子的水解,故溶液中离子浓度大小顺序是c(
)>c(H+)>c(OH-);(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液为一水合氨和氯化铵比1:1形成的溶液,pH>7说明一水合氨的电离大于铵根离子的水解,故溶液中离子浓度大小顺序是c(![]() )>c(Cl-)>c(OH-)>c(H+)。
)>c(Cl-)>c(OH-)>c(H+)。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目