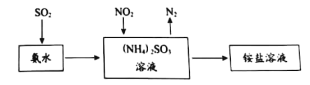
题目内容
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
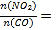
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
【答案】 2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H=-868.8kJ/mol 4×10-4mol/(L.min) 体系内气体颜色不再改变 ![]() 不移动 E(A) 低于300℃,反应未达到平衡,温度升高,反应速率加快;高于300℃,反应已平衡,随温度升高,反应逆向进行 活性炭在与铝粉形成的原电池中作正极,发生反应2NO2+8H++8e-=N2↑+4H2O,将NO2转化为无污染物质N2
不移动 E(A) 低于300℃,反应未达到平衡,温度升高,反应速率加快;高于300℃,反应已平衡,随温度升高,反应逆向进行 活性炭在与铝粉形成的原电池中作正极,发生反应2NO2+8H++8e-=N2↑+4H2O,将NO2转化为无污染物质N2
【解析】(1)反应①×4-②×2+③×1得到:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H=-868.8kJ/mol。
(2) 2NO2(g) + 4CO(g) = N2(g) + 4CO2(g)
起始: 0.1 0.2 0 0
反应: x 2x x/2 2x
平衡: 0.1-x 0.2-2x x/2 2x
恒温恒容压强的比等于气体的物质的量的比,所以![]() ,解得x=0.02mol。
,解得x=0.02mol。
①由上参加反应的CO为0.04mol,反应速率为![]() = 4×10-4mol/(L.min)。
= 4×10-4mol/(L.min)。
②反应达平衡以后所有物质的浓度都不变化,因为NO2的浓度不变,所以体系的颜色应该也不变化,则观察到颜色不变,证明反应达平衡。
③为增大污染物处理效率,应该保证反应尽量转化为生成物,即两个反应物都不过量,所以起始最佳投料比为![]() 。
。
④达平衡时一定有Q=K,现在仅将CO、CO2气体浓度分别增加一倍,因为两者的系数相等,且一个在分子一个在分母,所以浓度商的比值Q不变,即Q依然等于K,反应平衡不移动。
(3)①一般来说,反应的活化能越小,反应的速率越快,所以E(A)最小。
②曲线为在催化剂A作用下测得相同时间处理NO2的量与温度关系,则曲线上的点不一定代表平衡态。反应速率慢的时候,该时间段不能达平衡,则速率越快,反应的量越多;反应速率很快的时候,反应达平衡,则温度越高,平衡逆向移动,反应的量减少。所以原因为:低于300℃,反应未达到平衡,温度升高,反应速率加快;高于300℃,反应已平衡,随温度升高,反应逆向进行。
(4)明显这个处理过程是原电池,加入铝和碳就组成了原电池的两个电极,铝为负极,碳为正极,其表面应该发生NO2得电子转化为氮气的反应,所以方程式为:2NO2+8H++8e-=N2↑+4H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案