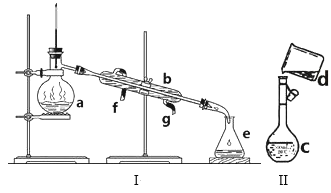
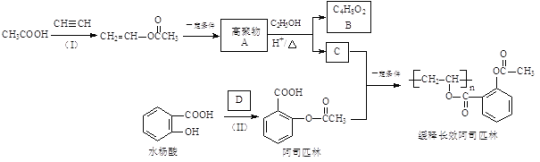
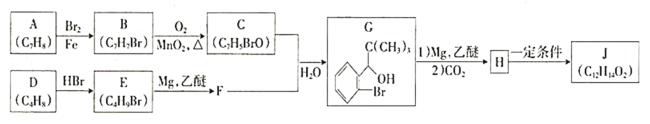
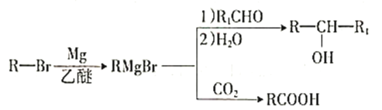
题目内容
【题目】下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请用对应的化学符号回答下列问题:

(1)D在元素周期表中的位置是____。
(2)E元素所形成的气态氢化物的电离方程式____。
(3)B、C两元素的单质较活泼的是___。(填元素符号)
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:___、___。
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为__。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为__C表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为___,该物质___(填“能”或“不能”)溶于氨水,___(填“能”或“不能”)溶于氢氧化钠溶液,若能写出发生反应的离子方程式___。
(7)G元素的非金属性比H元素的非金属性___(选填“强”、“弱”),能说明这一事实的化学方程式是___(任写一个)。
【答案】第三周期ⅣA族 HCl=H++Cl- Na 金刚石 石墨 固体溶解,有气泡冒出 2Al+Fe2O3=2Fe+Al2O3 还原性 BC Al(OH)3 不能 能 2Al+2OH+2H2O═2AlO2-+3H2↑ 强 O2+2H2S=2S↓+2H2O
【解析】
由元素在周期表中位置知;A.氟、B.钠、C.铝、D.硅、E.氯、F.碳、G.氧、H.硫。
(1)D元素在周期表第三行第四列,所以处于第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)E是氯元素,气态氢化物是HCl,是强电解质,电离方程式为HCl=H++Cl-
(3)Na、Al同周期,原子序数依次增大,故单质活泼性Na>Mg,故答案为:Na;
(4)碳有多种单质例金刚石、石墨、活性炭、C60等,任写两种;
(5)铝和氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,所以现象为:固体溶解,有气泡冒出,铝和氧化铁反应方程式为2Al+Fe2O3=2Fe+Al2O3,Al化合价升高,所以Al表现出来的性质是还原性,反应时发光放热使生成的金属熔化,所以现象是BC;
(6)Al的最高化合价是+3价,最高价氧化物对应的水化物的化学式为Al(OH)3, Al(OH)3能溶于强酸强碱不溶于弱酸弱碱,所以不能溶于氨水,能溶于氢氧化钠溶液,离子方程式为2Al+2OH+2H2O═2AlO2-+3H2↑;
(7)O和S处于同一主族,原子序数越大非金属性越弱,所以非金属性O比S强,非金属性强的能置换非金属性弱的,能说明的反应为:O2+2H2S=2S↓+2H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D
【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致