题目内容
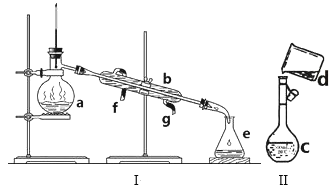
【题目】两同学为制得纯净的Fe(OH)2,使用如图所示的装置,A管中是Fe和H2SO4,B管中是NaOH溶液:

(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是___________;
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是___________,B中发生反应的离子方程式为____________________________________
(3)在制备纯净的Fe(OH)2实验中,一定要注意避免Fe(OH)2被氧化,一旦实验失败就会看到白色絮状沉淀逐渐变为灰绿色,最后变成红褐色,请写出这个过程的化学方程式,并用单线桥法标出电子转移的方向和数目:_________________________________
【答案】产生红褐色沉淀 有白色沉淀产生 Fe2++2OH-=Fe(OH)2↓ 
【解析】
(1)先夹紧止水夹a,使A管开始反应,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁;
(2)打开a,A中产生的氢气通过a进入B中,排出B中的空气,使A管中反应一段时间后再夹紧止水夹a,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁;
(3) Fe(OH)2在空气中被氧气氧化为Fe(OH)3;铁元素化合价由+2价升高为+3价。
(1)先夹紧止水夹a,使A管开始反应,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,在B管中观察到的现象是产生红褐色沉淀;
(2)打开a,A中产生的氢气通过a进入B中,排出B中的空气,使A管中反应一段时间后再夹紧止水夹a,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在B管中观察到的现象是有白色沉淀产生,反应的离子方程式为Fe2++2OH-=Fe(OH)2↓;
(3) Fe(OH)2在空气中被氧气氧化为Fe(OH)3,反应方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3;铁元素化合价由+2价升高为+3价,电子转移的方向和数目可表示为 。
。