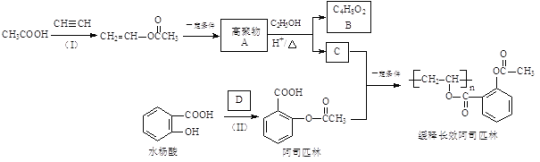
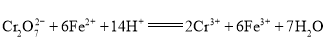题目内容
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式______________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备![]() ,写出阳极的电极反应式:_______。
,写出阳极的电极反应式:_______。
(3)某课题组以上述废玻璃粉末(含有SiO2,Fe2O3,CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净,沉淀洗涤的的操作是_______。
②反应①的离子方程式为____________。
③操作I的名称是_____________。
④已知:M[Ce(OH)4]=208g/mol,氧化还原滴定法测定制得的Ce(OH)4产品纯度的流程为:称取0.600gCe(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4标准液滴定,消耗25.00mL标准液。该产品中Ce(OH)4的质量分数为____________(小数点后保留两位),若滴定所用FeSO4溶液己在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度___________(“偏高”、“偏低”或“无影响”)。
【答案】4Ge(OH)CO3+O2=4GeO2+4CO2+2H2O 2O2ˉ-4eˉ=O2↑ 在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 冷却结晶 86.67% 偏大
【解析】
废玻璃粉末加氢氧化钠溶液后过滤,二氧化硅溶解,得到滤渣A的成分是Fe2O3、CeO2;滤渣A加稀硫酸后Fe2O3溶解,过滤得到滤液B为硫酸铁溶液,滤渣B主要含CeO2;加热蒸发硫酸铁溶液,并加入热的浓硫酸铵溶液,混合保温,之后经冷却结晶,过滤、洗涤,常温晾干得到硫酸铁铵;滤渣B加稀硫酸和双氧水溶解得到含Ce3+的溶液,Ce元化合价降低,说明被双氧水还原,所以同时有氧气生成,之后向溶液中加入碱溶液得到Ce(OH)3悬浊液,Ce(OH)3悬浊液通入氧气被氧化生成Ce(OH)4。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该过程中Ce元素被氧化,由于在空气中煅烧,所以氧化剂应为氧气,结合电子守恒和元素守恒可知该反应方程式为4Ge(OH)CO3+O2=4GeO2+4CO2+2H2O;
(2)熔融状态的CeO2可电离生成Ce4+和O2ˉ,电解过程中阳极发生氧化反应,应为O2ˉ被氧化生成氧气,方程式为2O2ˉ-4eˉ=O2↑;
(3)①洗涤沉淀的具体操作为:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作;
②结合分析可知CeO2与稀硫酸和H2O2的混合液反应生成Ce2(SO4)3和O2,结合电子守恒和电荷守恒可得离子方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
③滤液B主要含有硫酸铁,加入热的浓硫酸铵溶液,混合保温,之后经冷却结晶,过滤、洗涤,常温晾干可得硫酸铁铵;
④滴定过程中发生反应Ce4++Fe2+=Fe3++Ce3+,依据元素守恒计算n[Ce(OH)4]=n(Fe2+)=0.1000mol/L×0.0250L=2.5×10-3mol,所以Ce(OH)4的质量分数为![]() =86.67%;FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁标准液体积增大,测定该Ce(OH)4产品的质量分数会偏高。
=86.67%;FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁标准液体积增大,测定该Ce(OH)4产品的质量分数会偏高。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案