题目内容
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:
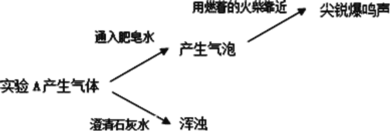
(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。
【答案】Mg+2H2O=Mg(OH)2+H2↑ CO2 CO32- Mg4(OH)2(CO3)3 在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动,Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-、OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。
【解析】
该学习小组探究 Mg 与NaHCO3溶液反应的机理,根据产生的气体具有可燃性可知气体中有H2;根据产生的气体能使澄清的石灰水变浑浊,可以确定其中有CO2;根据实验三可知反应后的溶液中有CO32-;根据定量实验的数据可以确定沉淀的化学式;根据平衡移动原理可说明该反应的机理。
(1)镁在常温下可以与水缓慢反应生成氢氧化镁和氢气,所以B 中生成气体的化学方程式为Mg+2H2O=Mg(OH)2+H2↑。
(2)实验 A 产生的气体能使澄清的石灰水变浑浊,说明A中产生的气体中还有CO2。
(3)分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴BaCl2溶液,A 中立即产生白色沉淀,该沉淀可能为碳酸钡,说明 Mg 与NaHCO3溶液反应产生了CO32-。
(4)取 0.1mol 白色沉淀加入 1mol/L 盐酸 800mL 恰好完全反应,根据Cl-守恒可知n(MgCl2)=0.4mol;根据产生标况下的CO2气体 6.72L,可知CO2气体的物质的量为0.3mol,则n(CO32-)=0.3mol;根据电荷守恒可知,n(OH-)=0.2mol。因此,白色沉淀的主要成分为Mg4(OH)2(CO3)3。
(5)在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-。Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动,Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-、OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。综上所述,实验 A 中产生现象的原因是:在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动;Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-和OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。